
【题目】下图Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ是常见的气体制备,净化,收集装置,根据要求回答下列问题:
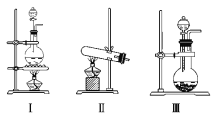
(1)若用MnO2与浓盐酸反应制取氯气,应选用发生装置_______,用化学方程式表示制取氯气的反应原理是______________________。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用发生装置__________,试完成并配平下列离子方程式:_____MnO4- + ____Cl- + ____H+ === ____Mn2+ + ____Cl2↑ + ____。
(3)若选用MnO2与浓盐酸反应制取的氯气含有杂质气体。可以选择 装置来除杂,装置中盛放的溶液依次为 和 。
(4)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用________溶液浸湿,其作用是_______________________。
(5)若选用Ⅴ为氯气收集装置,则氯气应从__________口通入。用化学方法检验氯气收集满了的方法是_____________________
(6)氯气有毒,可选择通过 溶液来处理尾气。发生的离子方程式为 。
【答案】(1)Ⅰ;MnO2+4HC1(浓)![]() MnC12+C12↑+2H2O;
MnC12+C12↑+2H2O;
(2)Ⅲ;2;10;16;2;5;8H2O;
(3) Ⅴ;饱和食盐水;浓硫酸;
(4)氢氧化钠;防止氯气逸出污染空气;
(5)A;将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满
(6)NaOH;Cl2+2OH-=Cl-+ClO-+H2O
【解析】
试题分析:(1)二氧化锰和浓盐酸的反应是固液混合加热型,所以选择Ⅰ装置;在加热条件下,二氧化锰和浓盐酸反应生成氯化锰、氯气和水,MnO2+4HC1(浓)![]() MnC12+C12↑+2H2O,故答案为:Ⅰ;MnO2+4HC1(浓)
MnC12+C12↑+2H2O,故答案为:Ⅰ;MnO2+4HC1(浓)![]() MnC12+C12↑+2H2O;
MnC12+C12↑+2H2O;
(2)KMnO4与浓盐酸的反应是固液混合不需要加热的,所以应选择Ⅲ装置;MnO4-中锰元素的化合价是+7价,Mn2+的化合价是+2价,所以一个MnO4-生成Mn2+得5个电子,生成一个C12分子需要2个氯离子失去2个电子,所以得失电子的最小公倍数是10,再根据元素守恒知,生成物中还有水;所以该离子方程式中的计量数分别为:2、10、16、2、5、8,故答案为:Ⅲ;2;10;16;2;5;8H2O;
(3)若选用MnO2与浓盐酸反应制取的氯气,由于浓盐酸检验挥发性,制得的气体中含有杂质气体氯化氢和水蒸气。可以选择Ⅴ装置来除杂,除杂时先用饱和食盐水除去氯化氢,再用浓硫酸除去水蒸气,故答案为:Ⅴ;饱和食盐水;浓硫酸;
(4)氯气有毒,逸出会污染大气,所以不能让氯气逸出;氯气和水能反应是盐酸和次氯酸,盐酸和次氯酸是酸,都能和碱反应,所以可用氢氧化钠溶液吸收氯气,故答案为:氢氧化钠;防止氯气逸出污染空气;
(5)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口;氯气的氧化性大于碘的氧化性,所以氯气能置换出碘化钾中的碘,且碘遇淀粉变蓝色,所以可用湿润的淀粉KI试纸检验是否收集满了氯气,故答案为:A;将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满
(6)氯气有毒,可选择通过氢氧化钠溶液来处理尾气。发生的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:NaOH;Cl2+2OH-=Cl-+ClO-+H2O。


科目:高中化学 来源: 题型:
【题目】若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者的物质的量浓度值比应为( )
A. 10:1 B. 5:1 C. 1:1 D. 1:10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向容器的体积为4L的密闭容器中通入1mol N2和3mol H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后。试回答下列问题:
2NH3(g)△H<0,达到平衡后。试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=____________。 达到平衡后,若其它条不变,升高体系的温度,平衡常数K将 (填“增大”、“减小”或“不变”)。
(2)达到平衡后,在恒容条件下,向容器中通入氦气(He),氮气的转化率将_______(“增大”、“减小”或“不变”,下同)。 若再通入1mol N2和3mol H2,氮气的转化率将 。
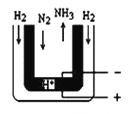
(3)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为
(4)三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是 ;
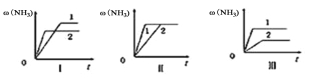
a.图Ⅰ可能是不同温度对反应的影响,且T2>T1
b.图Ⅲ可能是不同压强对反应的影响,且p1>p2
c.图Ⅱ可能是同温同压下,催化剂性能,1>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y、Z三种金属,X、Y组成原电池,X是负极;把Z放入X的硝酸盐溶液中,Z表面有X析 出.三者的金属活动性顺序是( )
A.X>Y>Z B.Z>X>Y C.X>Z>Y D.Y>X>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HF、H2O、CH4、SiH4四种气态氢化物按稳定性由弱到强排列正确的是( )
A. CH4<H2O<HF<SiH4
B. SiH4<HF<CH4<H2O
C. SiH4<CH4<H2O<HF
D. H2O<CH4<HF<SiH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置图的叙述中,正确的是
A.装置①可用于分离碘和氯化钠的固体混合物
B.装置②可用于吸收HCl或NH3
C.装置③可用于分解NH4HCO3制备NH3
D.装置④的b口进气可收集CO2或NO
查看答案和解析>>
科目:高中化学 来源: 题型:
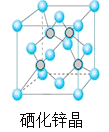
【题目】硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为 。
(2)锗、砷、硒的第一电离能大小排序为 。
(3)H2SeO3的中心原子杂化类型是 ;SeO32的立体构型是 。与SeO42互为等电体的分子有(写一种物质的化学式即可) 。
(4)H2Se属于 (填:极性或非极性)分子;单质硒的熔点为217℃,它属于 晶体。
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,若该晶胞密度为ρgcm3,硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为 pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是含碳、氢、氧三种元素的单官能团有机物。A水解得B和C,B可以氧化得到C或D,D氧化得到C。若M(X)表示X的摩尔质量,则下式中正确的是
A.M(A)=M(B)+M(C) B.2M(D)=M(B)+M(C)
C.M(B)< M(D)<M(C) D.M(D)<M(B)<M(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
(1) 其达到平衡状态的标志是____________________。
①氨的生成速率与氨的分解速率相等
②断开1个N≡N键的同时有6个N—H键生成
③N2、H2、NH3的体积分数不再变化
④气体的总压强不变
⑤N2、H2、NH3分子数之比为1:3:2
⑥N2、H2和NH3的浓度相等
⑦v(N2)=1/3v(H2)
⑧v正(N2)=1/3v逆(H2)
⑨混合物的密度不变
⑩混合物的平均相对分子质量不变
A.①③④⑤⑦⑩ B.①③④⑧⑩
C.①③④⑤⑧⑩ D.全部
(2)从反应开始到达到平衡用N2表示该反应的速率为: mol·L-1·min-1。
(3)平衡时H2的物质的量浓度为 mol·L-1。
(4)H2的转化率是____________。
(5)平衡时混合气体中NH3的体积分数是_______%(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com