
【题目】I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示其中Y所处的周期序数与族序数相等。按要求回答下列问题:


(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明X非金属性强于Z: _______________(用化学方程式表示)
(3)含Y的氯化物呈酸性的原因是__________ (用离子方程式表示)
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________;
(5)已知:①C(s)+ O2(g)= CO2(g)![]() H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"
H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"![]() H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)
H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)![]() H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
(6)已知:CO(g)+H2O(g)![]() H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的![]() H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
【答案】(1)![]()
(2)2HNO3+Na2SiO3=2NaNO3+H2SiO3↓
(3)Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
(4)Si-4e-+6OH-=SiO32-+3H2O
(5)2C(s)+SiO2(s)="Si(s)+2CO(g)" △H=(a+b-c)kJ·mol-1
(6)<75%
【解析】试题分析:X为氮,Y为铝,Z为硅,W为氯。(1)X为氮元素,原子结构示意图为;![]()
(2)非金属性越前,其最高价氧化物对应的水化物的酸性越强,所以可以用硝酸制取硅酸即可,方程式为:2HNO3+Na2SiO3=2NaNO3+H2SiO3↓。(3)氯化铝溶液中铝离子水解使溶液显酸性,离子方程式为:Al3++3H2O![]() Al(OH)3+3H+。(4)根据反应分析,硅失去电子生成硅酸根离子,电极反应为:Si-4e-+6OH-=SiO32-+3H2O。(5)根据盖斯定律分析,①+②-③即可得热化学方程式为:2C(s)+SiO2(s)="Si(s)+2CO(g)" △H=(a+b-c)kJ·mol-1。(6)从表分析,温度升高,平衡常数变小,说明升温平衡逆向移动,则正反应为放热反应,△H<0,
Al(OH)3+3H+。(4)根据反应分析,硅失去电子生成硅酸根离子,电极反应为:Si-4e-+6OH-=SiO32-+3H2O。(5)根据盖斯定律分析,①+②-③即可得热化学方程式为:2C(s)+SiO2(s)="Si(s)+2CO(g)" △H=(a+b-c)kJ·mol-1。(6)从表分析,温度升高,平衡常数变小,说明升温平衡逆向移动,则正反应为放热反应,△H<0,
CO(g)+H2O(g)![]() H2(g) + CO2(g)
H2(g) + CO2(g)
起始浓度 1 1 0 0
改变浓度x x x x
平衡浓度 1-x 1-x x x
则有x2/(1-x)2=9,解x=0.75,则一氧化碳的转化率为0.75/1=75%


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
(1) 其达到平衡状态的标志是____________________。
①氨的生成速率与氨的分解速率相等
②断开1个N≡N键的同时有6个N—H键生成
③N2、H2、NH3的体积分数不再变化
④气体的总压强不变
⑤N2、H2、NH3分子数之比为1:3:2
⑥N2、H2和NH3的浓度相等
⑦v(N2)=1/3v(H2)
⑧v正(N2)=1/3v逆(H2)
⑨混合物的密度不变
⑩混合物的平均相对分子质量不变
A.①③④⑤⑦⑩ B.①③④⑧⑩
C.①③④⑤⑧⑩ D.全部
(2)从反应开始到达到平衡用N2表示该反应的速率为: mol·L-1·min-1。
(3)平衡时H2的物质的量浓度为 mol·L-1。
(4)H2的转化率是____________。
(5)平衡时混合气体中NH3的体积分数是_______%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。工业用乙二醇(HOCH2CH2OH)氧化法生产乙二醛。
(1)已知:OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g)△H=-78kJmol-1
HOCH2CH2OH(g)△H=-78kJmol-1
2H2(g)+O2(g)![]() 2H2O(l)△H=-571.6kJmol-1
2H2O(l)△H=-571.6kJmol-1
H2O(g)=H2O(l)△H=-44kJmol-1
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)的 △H=__________kJmol-1 ;
OHC-CHO(g)+2H2O(g)的 △H=__________kJmol-1 ;
(2)上述制乙二醛反应的化学平衡常数表达式K=________;当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间时,乙二醛产率降低的主要原因是________;当温度超过495℃时,乙二醛产率降低的主要原因是________;

(3)产品中乙二醛含量测定的实验过程如下:
准确量取25.00mL乙二醛样品置于锥形瓶中,加入盐酸羟胺(NH2OH·HCl)溶液,使乙二醛充分反应,用0.1000mol/L的NaOH溶液滴定生成的盐酸至终点(为了避免滴定剂与溶液中过量的NH2OH·HCl反应,选择溴酚蓝作指示剂),消耗NaOH溶液12.50mL,计算样品中乙二醛的含量(g/L)。(写出计算过程)
(已知:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2) 铁元素位于元素周期表中的第 族,在水溶液中常以Fe2+、Fe3+的形式存在,其中 更稳定。基态Fe原子有________个未成对电子。
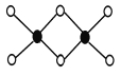
(3)工业上冶炼铝不用氯化铝,因为氯化铝易升华,其双聚物Al2Cl6结构如图所示。1mol该分子中含 个配位键,该分子 (填“是”或“否”)平面型分子。
(4) Fe(CO)5 是一种配位化合物,该物质常温下呈液态,熔点为一20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断:该化合物的晶体中存在的作用力有( )
A.离子键 B.极性键 C.非极性键 D.范德华力 E.氢键 F.配位键
(5)很多金属盐都可以发生焰色反应,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
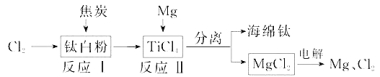
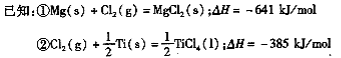
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为 ;
(2)反应I在800~900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为: ;
(3)反应Ⅱ的热化学方程式为 ;
(4)该工艺流程中,可以循环使用的物质有 ;
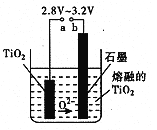
(5)在800 ~1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的 极,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现黑色和红色交替的现象,请写出此过程总的化学反应方程式____________________________________。
(2)甲和乙两个水浴作用不相同,其中甲的作用是______ _____。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们有水和________ _____ __ __。集气瓶中收集到的气体的主要成分是_____________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,要除去该物质,可先在混合液中加入________(填字母序号),
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过__________(填实验操作名称)操作即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A. 18个纵横代表18个族,7个主族、8个副族
B. 短周期共有32种元素
C. 元素周期表共有七个横行代表七个周期
D. 第IA族全部是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com