
【题目】下列关于元素周期表的说法正确的是( )
A. 18个纵横代表18个族,7个主族、8个副族
B. 短周期共有32种元素
C. 元素周期表共有七个横行代表七个周期
D. 第IA族全部是金属元素
科目:高中化学 来源: 题型:
【题目】I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示其中Y所处的周期序数与族序数相等。按要求回答下列问题:


(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明X非金属性强于Z: _______________(用化学方程式表示)
(3)含Y的氯化物呈酸性的原因是__________ (用离子方程式表示)
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________;
(5)已知:①C(s)+ O2(g)= CO2(g)![]() H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"
H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"![]() H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)
H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)![]() H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
(6)已知:CO(g)+H2O(g)![]() H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的![]() H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质的成分。

(1)写出装置A中发生反应的化学方程式: 。
(2)装置B的主要作用是 。
(3)向C装置中通入一定量的氯气后,测得只生成一种气体(常温下为棕黄色,且为氯的氧化物)。可以确定的是C得到的固体最多含有三种物质,含有氯元素的盐只有一种,且含有NaHCO3,现对C中得到的固体成分进行猜想和验证。
① 提出合理猜想一定含有NaHCO3和 ;可能含有剩余的Na2CO3。
② 设计方案,进行成分检验。请完成实验步骤3、4以及预期现象和结论
限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸。
1、实验步骤 | 2、预期现象和结论 |
3、步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于甲、乙两支试管中。 | 4、得到无色溶液 |
5、步骤2:向甲试管中加入过量的BaCl2溶液,静置 | 6、若溶液变浑浊,证明固体中含碳酸钠。 |
7、步骤3: | 8、 |
9、步骤4: | 10、 |
(4)完成C中反应的化学方程式:2Cl2+2Na2CO3+H2O= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
(1)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。

(2)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
(3)为安全起见,工业生产中需对空气中的CO进行检测。
①粉红色的PdCl2溶液可以检测空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀,每生成5.3gPd沉淀,反应中转移的电子数为 。
②使用电化学CO气体传感器定量检测空气中CO含量,其模型如图所示。这种传感器利用了原电池原理,则该电池的负极反应式为 。

(4)CO与Fe在一定条件下可形成五羰基铁[Fe(CO)5],该化合物易吸收H2生成氢化羰基铁。氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠。五羰基铁吸收H2的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式其中正确的是
A. 碳酸钙与盐酸反应:CO32—+ 2H+= CO2↑ + H2O
B. 氨水与盐酸反应:OH—+ H+= H2O
C. 氢氧化钡溶液与硫酸反应:Ba2++ OH—+ H++ SO42—= BaSO4↓+ H2O
D. 铁与氯化铁溶液反应:Fe + 2Fe3+= 3Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙较稳定,不溶于乙醇,微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。
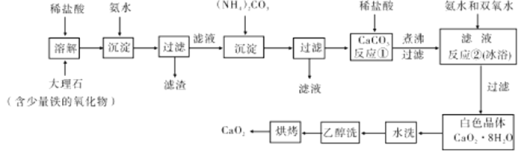
回答下列问题:
(1)大理石经过溶解、沉淀、过滤、在沉淀、再过滤,得到CaCO3,其目的是 ;过滤需要用到的玻璃仪器主要有漏斗、烧杯和 。
(2)反应①的具体操作作为逐滴加入稀盐酸,至溶液中尚存有少量固体。将溶液煮沸,趁热过滤。将溶液煮沸的作用是 。
(3)反应②的化学方程式为 ,该反应需要在冰浴下进行,原因是 。
(4)白色晶体水洗时,判断是否洗净的方法是 ;使用乙醉洗涤的目的是 。
(5)制备过氧化钙的另一种方法是:将石灰石锻烧后.直接加人双氧水反应,过滤后可得到过氧化钙产品。该法的优点是工艺简单、操作简单.所得产品的缺点是 。
(6)CaO2·8H2O加热脱水的过程中,需不断通入氧气.目的是抑制过氧化钙分解。若通入的氧气中混有二氧化碳,其后果是 ;已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
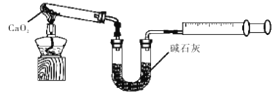
若所取产品质量为ag,测得生成气体的体积为VmL(已换算成标准状况),则产品中CaO2的质量分数为 (用含a、V的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:

以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)

已知以下信息:
1、A中有五种不同化学环境的氢
2、B可与FeCl3溶液发生显色反应
3、同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1) 香豆素的分子式为______________;
(2) 由B生成C的化学反应方程式为____________________________________________;
(3) B的同分异构体中含有苯环的还有________________种,其中在核磁共振氢谱中只出现四组峰的有
_________________种;
(4)D的同分异构体中含有苯环的既能发生银镜反应,又能发生水解反应的是______________________(写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
(一)NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2 CO2(g) △H=-566.00kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式____________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化如图所示。

①T℃时该化学反应的平衡常数K=_________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8 mol,平衡将_______移动。(填“向左”、“向右”或“不”)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________。(填“a”或“b”)
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____________。
(二)SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-。该反应的离子方程式是_____________。
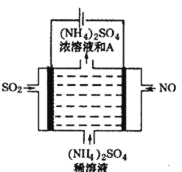
(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。
①写出物质A的化学式_____________,阳极的电极反应式是____________Cl。
②该电解反应的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com