
����Ŀ���о����֣�NOx��SO2����������Ҫ�ɷ֡�
��һ��NOx��Ҫ��Դ������β����
��֪��N2��g����O2��g��![]() 2NO��g�� ��H����180.50 kJ��mol��1
2NO��g�� ��H����180.50 kJ��mol��1
2CO��g����O2��g��![]() 2 CO2��g�� ��H����566.00kJ��mol��1
2 CO2��g�� ��H����566.00kJ��mol��1
��1��Ϊ�˼��������Ⱦ���������������β�������ܿڲ��ô�����NO��COת��������Ⱦ����������ѭ����д���÷�Ӧ���Ȼ�ѧ����ʽ____________��
��2��T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2L���ܱ������У������¶Ⱥ�������䣬��Ӧ���̣�0��15min����NO�����ʵ�����ʱ��仯��ͼ��ʾ��

��T��ʱ�û�ѧ��Ӧ��ƽ�ⳣ��K��_________��ƽ��ʱ�������¶Ȳ��䣬���������г���CO��N2��0.8 mol��ƽ�⽫_______�ƶ���������������ҡ�������
��ͼ��a��b�ֱ��ʾ��һ���¶��£�ʹ��������ͬ���������ͬ�Ĵ���ʱ���ﵽƽ�������n��NO���ı仯���ߣ����б�ʾ����������ϴ��������__________�����a����b����
��15minʱ�����ı���練Ӧ����������n��NO��������ͼ��ʾ�ı仯����ı������������____________��
������SO2��Ҫ��Դ��ú��ȼ�ա�ȼú��������������Ǽ��ٴ����к�������Ⱦ�Ĺؼ���
��3���ô�����Һ����SO2�ɽ���ת��ΪHSO3-���÷�Ӧ�����ӷ���ʽ��_____________��
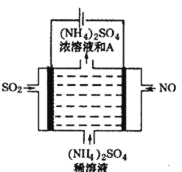
��4����ͼ���װ�ÿɽ������е�NO��SO2�ֱ�ת��ΪNH4+��SO42-��
��д������A�Ļ�ѧʽ_____________�������ĵ缫��Ӧʽ��____________Cl��
�ڸõ�ⷴӦ�Ļ�ѧ����ʽΪ________________��
���𰸡���1��2NO��g��+2CO��g��=2CO2��g��+N2��g�� ��H =-746.50 kJ��mol��1
��2����5(mol/L)��1 ����
��b ������CO�����ʵ���Ũ�Ȼ�����ѹǿ
��3��H2O+2SO2+CO32-��2HSO3��+CO2��
��4����H2SO4 SO2+2H2O-2e����SO42-+4H+
��5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4
(NH4)2SO4+4H2SO4
��������
�����������1����֪���� N2��g����O2��g��![]() 2NO��g�� ��H����180.50 kJ��mol��1
2NO��g�� ��H����180.50 kJ��mol��1
�� 2CO��g����O2��g��![]() 2 CO2��g�� ��H����566.00kJ��mol��1
2 CO2��g�� ��H����566.00kJ��mol��1
���ݸ�˹�������������õ�2NO��g��+2CO��g��=2CO2��g��+N2��g�� ��H =-746.50 kJ��mol��1��
��2������ʼʱ��NOΪ0.4mol��ƽ��ʱNOΪ0.2mol����
2NO��g��+2CO��g��=2CO2��g��+N2��g��
��ʼ���ʵ�����0.4mol 0.4mol 0 0
ת������������0.2mol 0.2mol 0.2mol 0.1mol
ƽ�����ʵ�����0.2mol 0.2mol 0.2mol 0.1mol
��ƽ��ʱ��Ũ�ȣ�c��NO��=0.1mol/L��c��CO��=0.1mol/L��c��CO2��=0.1mol/L��c��N2��=0.05mol/L��
����ƽ�ⳣ��K��![]() =5��mol/L��-1��
=5��mol/L��-1��
ƽ��ʱ�������¶Ȳ��������������г���CO��N2��0.8mol����c��CO��=0.5mol/L��c��N2��=0.45mol/L��
Qc��![]() ��1.8��5����ƽ�⽫�����ƶ���
��1.8��5����ƽ�⽫�����ƶ���
������������ϴ�Ӧ���ʿ죬�ﵽƽ������ʱ��̣���ͼ��֪��b���ߴ����������·�Ӧ���ʿ죬����b�Ĵ����ı������
����ͼ���֪��NO��Ũ�ȼ�С��ƽ�����������ƶ������Ըı������Ϊ����CO�����ʵ���Ũ�Ȼ�����ѹǿ��
��3��̼������Һ��SO2��Ӧ�������������ƺͶ�����̼���䷴Ӧ�����ӷ���ʽΪH2O+2SO2+CO32-��2HSO3��+CO2����
��4�����װ�D�ɽ������е�NO��SO2�ֱ�ת��ΪNH4+��SO42-�����ⷽ��ʽΪ5SO2 + 2NO + 8H2O ![]() (NH4)2SO4 + 4H2SO4����
(NH4)2SO4 + 4H2SO4����
���ɵ�ⷽ��ʽ��֪������AΪ���ᣬ��Ļ�ѧʽH2SO4�� ���ʱ�������϶�������ʧ����������������ӣ��������ĵ缫��Ӧʽ��SO2+2H2O-2e����SO42-+4H+��
���������Ϸ�����֪�õ�ⷴӦ�Ļ�ѧ����ʽΪ5SO2 + 2NO + 8H2O![]() ( NH4)2SO4 + 4H2SO4��
( NH4)2SO4 + 4H2SO4��


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ԫ�����ڱ���˵����ȷ���ǣ� ��
A. 18���ݺ����18���壬7�����塢8������
B. �����ڹ���32��Ԫ��
C. Ԫ�����ڱ������߸����д����߸�����
D. ��IA��ȫ���ǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ��ѡ��3�����ʽṹ������]
A��B��C��D��E��ǰ������ԭ�������������������Ԫ�ء�AԪ��ԭ�ӵĺ�����ӵ�������Ӳ�����BԪ�ػ�̬ԭ���������ܼ���������ͬ��A��D���γ����ֳ���Һ̬������ס��ң���ԭ����֮�ȷֱ�Ϊ1:1,2:1��EԪ��ԭ�ӵ�K��L�������֮�͵�����M��N�������֮�͡��ش��������⣨�漰Ԫ������Ӧ��ѧ���ű�ʾ����
��1��B��C��D����Ԫ���е縺������Ԫ�����̬ԭ�ӵĵ����Ų�ʽΪ ��
��2������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ����� ������������B�Ļ�̬ԭ���У�������� �������෴�ĵ��ӡ�
��3����E��D�γɵľ�����ͼ1��ʾ��������E2����Χ�Ⱦ��������E2���� ����ED����ɫ��ӦΪש��ɫ��������������ǵĻ����ﶼ���Է�����ɫ��Ӧ����ɫ��Ӧ��ԭ���� ��E��B���γɵľ���ľ����ṹ��NaCl��������ƣ���ͼ2��ʾ�������þ����к��е�������B22���Ĵ��ڣ�ʹ������һ������������������E2+����λ��Ϊ_______________���û�����Ļ�ѧʽΪ ��
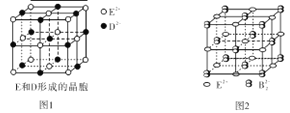
��4���ø�����������Һ̬��������ʱ��һ���ҷ������ͷų�һ�����ӣ�ͬʱ����һ�������ӡ�
���ͷų����ĵ��ӿ��Ա������ҷ����γɵġ����������ҷ��Ӽ����γɡ�������ԭ���� ��
�����ҷ����ͷų�����ʱ������һ�������Ӿ��н�ǿ�������ԣ���д������������SO2��ˮ��Һ��Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ӽ���Ĥ�������ӽ���Ĥ��ʯī�缫����ͼZ99��ʾ���ۡ����ȼҵ�е����ӽ�������ԭ�����ɵ��Na2SO4��Һ����NaOH��H2SO4��Һ��

����˵����ȷ����( )
A��������ӦʽΪ2H����2e��===H2��
B����A�ڳ�������H2SO4��Һ
C��a�������ӽ���Ĥ������H��ͨ��
D��Na2SO4��Һ��E�ڼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���֬��������,�������
A����֬���ӽṹ����������һ����ͬ
B�������ô�����Һȥ������
C�������ô�������ֲ���ͺͲ���
D����ҵ�Ͽ�����֬�����֬����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������л�Ϊͬϵ�����
A��CH��CH��CH2��CH��CH=CH2
B��CH3��CH=CH2��CH3��CH2��CH=CH2
C��CH3��CH3��CH3��CH=CH2
D��CH2= CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��ijѧ����0.2000 mol��L��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����
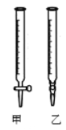
��������ˮϴ�Ӽ�ʽ�ζ�������ע��NaOH��Һ����0���̶�������
���̶��õζ��ܲ�ʹ�ζ��ܼ������Һ��
������Һ������0����0���̶������£������¶���
����ȡ20.00mL����Һע��ྻ����ƿ�У�������3�η�̪��Һ
���ñ�Һ�ζ����յ㣬���µζ���Һ�����
��ش�
��1�����ϲ����д������ǣ����ţ� ��
��2���ñ�NaOH��Һ�ζ�ʱ��Ӧ����NaOH��Һע��______��������ͼ��ѡ��ס����ҡ���
��3�����в���������ʵ����ƫ����ǣ�______�����ţ�
A������ƿװҺǰ��������������ˮ
B���ζ�ǰ���ζ��ܼ��������ݣ��ζ���������
C����ƿ��������ˮϴ�Ӻ�δ�ô���Һ��ϴ
D������ʽ�ζ�����ȡҺ��ʱ���ͷ�Һ��ǰ�ζ���ǰ�������ݣ�֮����ʧ
��4���ζ�ʱ�����ֿ��Ƶζ��ܣ�����ҡ����ƿ���۾�ע�� ���жϵ���ζ��յ�������ǣ���ƿ����Һ ��
��5��������ʵ�����ݼ�¼��
�ζ����� | �������mL | NaOH��Һ���������mL�� | |
�ζ�ǰ | �ζ��� | ||
1 | 20.00 | 0.00 | 21.30 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.32 |
ͨ������ɵã�������Ũ��Ϊ��______ molL-1������������4λС����
II�����ü�����ζ����ɲⶨBa2���ĺ�����ʵ����������С�
��֪��2CrO42����2H����Cr2O72����H2O Ba2����CrO42����BaCrO4��
����1����ȡx mLһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b mol��L��1�����Һ�ζ����յ㣬��õμ��������ΪV0 mL��
����2����ȡy mL BaCl2��Һ����ƿ�У�����x mL�벽��:1��ͬŨ�ȵ�Na2CrO4��Һ����Ba2����ȫ�������ټ������ָʾ������b mol��L��1�����Һ�ζ����յ㣬��õμ���������ΪV1 mL��
��BaCl2��ҺŨ��Ϊ______________________ mol��L��1��������2�еμ�����ʱ����������Һ��������Ba2��Ũ�ȵIJ���ֵ��___________���ƫ��ƫС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����°����ҹ�������ѧ�ң�1933����桶�������졷һ�飬�������й��Լ����Ƽ�ա��䴿������ԭ������ͼ��ʾ��

��1����NaHCO3�Ʊ�����Ļ�ѧ����ʽ��_________________��
��2��������ͨ��NH3��CO2��˳����__________________��
��3������������NH4Cl(s)��ԭ����_____________��
��4��������ø���ƷNH4Cl����NH3��HCl��ֱ�Ӽ��ȷֽ�NH4Cl��NH3��HCl�IJ��������ܵͣ�ԭ����________________��
��5������MgOѭ���ֽ�NH4Cl�����ȣ���300�����»��NH3������������350����600�����HCl���塣��������װ��(���ȼ��ӳ�װ����)�ɲ���NH3��HCl�IJ��ʡ�

�� ����300��ʱ�������ʢװ�ĸ������_________��NH3������ȫ���������������װ���е�����Һ��
�� ����NH3�Ļ�ѧ��Ӧ����ʽ��_________________��
�� ��350����600������ͼ���߿���Ӧѡ��İ�ȫƿ��________��

�� MgO����ѭ���ֽ�NH4Cl�Ƶ�NH3��HCl��ԭ����____________(��ϻ�ѧ����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������X��Z��W����Ԫ�ؿ����XH3��H2Z��HW���ۻ����Y����Ԫ�ؿ����Y2O��Y2O2���ӻ����
��1��д��Y2O2�ĵ���ʽ��_________________�����к��еĻ�ѧ����_______________��
��2���õ���ʽ��ʾY2O���γɹ��̣�____________________________________��
��3����X��W��ɵĻ���������У�X��Wԭ�ӵ��������ﵽ8�����ȶ��ṹ���û�������ˮ������һ�־���Ư���ԵĻ������д����Ӧ�Ļ�ѧ����ʽ��___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com