
【题目】侯德榜是我国著名科学家,1933年出版《纯碱制造》一书,创立了中国自己的制碱工艺。其纯碱制造原理如下图所示:

(1)由NaHCO3制备纯碱的化学方程式是_________________。
(2)过程Ⅰ通入NH3和CO2的顺序是__________________。
(3)过程Ⅱ析出NH4Cl(s)的原因是_____________。
(4)充分利用副产品NH4Cl生产NH3和HCl。直接加热分解NH4Cl,NH3和HCl的产率往往很低,原因是________________。
(5)采用MgO循环分解NH4Cl。加热,在300℃以下获得NH3;继续加热至350℃~600℃获得HCl气体。利用下列装置(加热及加持装置略)可测量NH3和HCl的产率。

① 低于300℃时,干燥管盛装的干燥剂是_________。NH3吸收完全后,更换干燥剂和吸收装置中的吸收液。
② 产生NH3的化学反应方程式是_________________。
③ 在350℃~600℃,上图虚线框内应选择的安全瓶是________。

④ MgO可以循环分解NH4Cl制得NH3和HCl的原因是____________(结合化学方程式解释)。
【答案】(1)2NaHCO3![]() Na2CO3 +H2O + CO2↑
Na2CO3 +H2O + CO2↑
(2)先通NH3,后通CO2
(3)NH4Cl(s) ![]() NH4+(aq) + Cl-(aq),增大c(Cl-),平衡左移,促进氯化铵析出;
NH4+(aq) + Cl-(aq),增大c(Cl-),平衡左移,促进氯化铵析出;
(4)NH3 + HCl = NH4Cl
(5)① 碱石灰;② MgO + 2NH4Cl ![]() 2NH3↑+ MgCl2 + H2O↑ ;③ c ;④ 因为MgO+2NH4Cl
2NH3↑+ MgCl2 + H2O↑ ;③ c ;④ 因为MgO+2NH4Cl![]() 2NH3↑+MgCl2+ H2O↑, 而MgCl2水解生成Mg(OH)2和HCl,MgCl2+2H2O
2NH3↑+MgCl2+ H2O↑, 而MgCl2水解生成Mg(OH)2和HCl,MgCl2+2H2O![]() Mg(OH)2+2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2
Mg(OH)2+2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2![]() MgO+H2O,所以MgO可以循环应用与NH4Cl反应制得NH3和HCl。
MgO+H2O,所以MgO可以循环应用与NH4Cl反应制得NH3和HCl。
【解析】
试题分析:(1)NaHCO3受热分解生成碳酸钠,化学方程式为2NaHCO3![]() Na2CO3 +H2O + CO2↑,故答案为:2NaHCO3
Na2CO3 +H2O + CO2↑,故答案为:2NaHCO3![]() Na2CO3 +H2O + CO2↑;
Na2CO3 +H2O + CO2↑;
(2)氨气易溶于水,二氧化碳在水中溶解度较小,因此过程Ⅰ应该先通入NH3后通入CO2,故答案为:先通NH3,后通CO2 ;
(3)NH4Cl溶液中存在NH4Cl(s) ![]() NH4+(aq) + Cl-(aq),加入氯化钠固体,c(Cl-)增大,平衡左移,促进氯化铵析出,故答案为:NH4Cl(s)
NH4+(aq) + Cl-(aq),加入氯化钠固体,c(Cl-)增大,平衡左移,促进氯化铵析出,故答案为:NH4Cl(s) ![]() NH4+(aq) + Cl-(aq),增大c(Cl-),平衡左移,促进氯化铵析出;
NH4+(aq) + Cl-(aq),增大c(Cl-),平衡左移,促进氯化铵析出;
(4)充分利用副产品。直接加热NH4Cl生产NH3和HCl,温度降低后NH3和HCl又化合生成氯化铵,导致产率往往很低,故答案为:NH3 + HCl = NH4Cl;
(5)① 低于300℃时获得NH3,干燥管应该盛装碱石灰,故答案为:碱石灰;
② 根据题意,氧化镁和氯化铵加热时生成了氨气,同时生成氯化镁和水,反应的化学反应方程式为MgO + 2NH4Cl ![]() 2NH3↑+ MgCl2 + H2O↑,故答案为:MgO + 2NH4Cl
2NH3↑+ MgCl2 + H2O↑,故答案为:MgO + 2NH4Cl ![]() 2NH3↑+ MgCl2 + H2O↑;
2NH3↑+ MgCl2 + H2O↑;
③ 氯化氢极易溶于水,安全瓶可以选择c装置,防止倒吸,影响实验,故答案为:c;
④ 因为MgO+2NH4Cl![]() 2NH3↑+MgCl2+ H2O↑,而MgCl2水解生成Mg(OH)2和HCl,MgCl2 + 2H2O
2NH3↑+MgCl2+ H2O↑,而MgCl2水解生成Mg(OH)2和HCl,MgCl2 + 2H2O ![]() Mg(OH)2 + 2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2
Mg(OH)2 + 2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2![]() MgO+H2O,所以MgO可以循环应用与NH4Cl反应制得NH3和HCl,故答案为:因为MgO+2NH4Cl
MgO+H2O,所以MgO可以循环应用与NH4Cl反应制得NH3和HCl,故答案为:因为MgO+2NH4Cl![]() 2NH3↑+MgCl2+ H2O↑,而MgCl2水解生成Mg(OH)2和HCl,MgCl2+2H2O
2NH3↑+MgCl2+ H2O↑,而MgCl2水解生成Mg(OH)2和HCl,MgCl2+2H2O![]() Mg(OH)2+2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2
Mg(OH)2+2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2![]() MgO+H2O,所以MgO可以循环应用与NH4Cl反应制得NH3和HCl。
MgO+H2O,所以MgO可以循环应用与NH4Cl反应制得NH3和HCl。


科目:高中化学 来源: 题型:
【题目】香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:

以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)

已知以下信息:
1、A中有五种不同化学环境的氢
2、B可与FeCl3溶液发生显色反应
3、同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1) 香豆素的分子式为______________;
(2) 由B生成C的化学反应方程式为____________________________________________;
(3) B的同分异构体中含有苯环的还有________________种,其中在核磁共振氢谱中只出现四组峰的有
_________________种;
(4)D的同分异构体中含有苯环的既能发生银镜反应,又能发生水解反应的是______________________(写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
(一)NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2 CO2(g) △H=-566.00kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式____________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化如图所示。

①T℃时该化学反应的平衡常数K=_________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8 mol,平衡将_______移动。(填“向左”、“向右”或“不”)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________。(填“a”或“b”)
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____________。
(二)SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-。该反应的离子方程式是_____________。
(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。
①写出物质A的化学式_____________,阳极的电极反应式是____________Cl。
②该电解反应的化学方程式为________________。
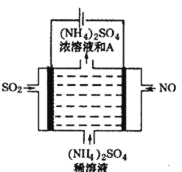
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应原理或过程,不能用勒夏特列原理解释的是
A. 用N2和H2合成氨需采用高压。
B. 由H2O2制氧气时使用MnO2催化剂。
C. 醋酸溶液加水稀释醋酸的电离度增大
D. 温度升高水的电离程度增大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用足量的盐酸跟一定量的锌反应制取一定体积的氢气,为了提高化学反应速率而又不影响生成氢气的体积,下列措施中合理的是( )
A.加入少量稀硫酸 B.加热
C.加蒸馏水 D.加入少量硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热熔器中进行,在0~3分钟内各物质的量的变化情况如图所示(已知A、B、C均为气体)。

(1)该反应的化学方程式为____________________________________。
(2)反应开始至2分钟时,B的平均反应速率为__________________。
(3)能说明该反应已达到平衡状态的是
A.V(A)=2V(B) B.容器内气体密度不变
C.V逆(A)=V正(C) D.容器内温度不变
(4)由图求得平衡时A的转化率为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,已知A、D是生活中常见的金属单质,B、C是氧化物,且B的相对分子质量是232。

请填空:
(1)C电解的化学方程式为___________________________________。
(2)写出A与B反应生成C和D的化学方程式_________________________。
(3)将A、D用导线连接后插入氢氧化钠溶液中,写出负极反应的方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】目前半导体生产展开了一场“铜芯片”革命—在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:


(1)基态铜原子的外围电子排布式为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是___,其立体结构是____。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液![]() 蓝色沉淀
蓝色沉淀![]() 沉淀溶解,得到深
沉淀溶解,得到深
蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式______;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________pm。((用含d和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是

A.该过程中,能量的转化形式只有两种
B.铝镓合金可以循环使用
C.铝镓合金与水反应的化学方程式为2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
D.总反应式为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com