
【题目】某反应在体积为5L的恒容密闭的绝热熔器中进行,在0~3分钟内各物质的量的变化情况如图所示(已知A、B、C均为气体)。

(1)该反应的化学方程式为____________________________________。
(2)反应开始至2分钟时,B的平均反应速率为__________________。
(3)能说明该反应已达到平衡状态的是
A.V(A)=2V(B) B.容器内气体密度不变
C.V逆(A)=V正(C) D.容器内温度不变
(4)由图求得平衡时A的转化率为_______________。
【答案】(1)2A + B ![]() 2C;(2)0.1mol.(L·min)-1;
2C;(2)0.1mol.(L·min)-1;
(3)C、D;(4)40%。
【解析】
试题分析:(1)根据图示可知A、B反应消耗,是反应物,C增加,是生成物,反应经过2min时,它们变化的物质的量分别是2、1、2,由于物质改变的物质的量的比等于方程式中该物质的化学计量数的比。2min后各种物质都存在,且物质的量不变,说明反应是可逆反应,因此该反应的化学方程式是2A + B ![]() 2C;(2)反应开始至2分钟时,B的平均反应速率为v(B)=1mol÷5L÷2min=0.1mol/(L·min);(3)A。未指明反应速率是正反应速率还是逆反应速率,所以不能判断反应是否达到平衡状态,错误;B.反应混合物都是气体,气体的质量不变,容器的容积不变,因此任何时刻气体的密度都不变,故不能判断反应是否处于平衡状态,错误;C.V逆(A)=V正(C),则各种物质的浓度不变,反应处于平衡状态,正确;D.任何反应都伴随着能量变化,若容器内温度不变,说明反应放出的热量不变,反应达到平衡状态,正确;(4)反应开始时A的物质的量是5mol,反应达到平衡时物质的量是3mol,反应了2mol,所以由图求得平衡时A的转化率为(2mol÷5mol)×100%=40%。
2C;(2)反应开始至2分钟时,B的平均反应速率为v(B)=1mol÷5L÷2min=0.1mol/(L·min);(3)A。未指明反应速率是正反应速率还是逆反应速率,所以不能判断反应是否达到平衡状态,错误;B.反应混合物都是气体,气体的质量不变,容器的容积不变,因此任何时刻气体的密度都不变,故不能判断反应是否处于平衡状态,错误;C.V逆(A)=V正(C),则各种物质的浓度不变,反应处于平衡状态,正确;D.任何反应都伴随着能量变化,若容器内温度不变,说明反应放出的热量不变,反应达到平衡状态,正确;(4)反应开始时A的物质的量是5mol,反应达到平衡时物质的量是3mol,反应了2mol,所以由图求得平衡时A的转化率为(2mol÷5mol)×100%=40%。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
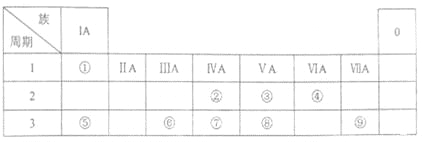
(1)⑨的原子结构示意图为 。
(2)②的气态氢化物分子的结构式为 ⑧的最高价氧化物的水化物的分子式 。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 。(填化学式)
(4)⑤、⑥元素的金属性强弱依次 。(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥形成的简单离子半径依次 。(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式 。
(7)⑤、⑥、⑨的最高价氧化物对应水化物两两均能反应,写出其反应的离子方程式。 、 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各对物质中互为同系物的是
A.CH≡CH和CH2=CH-CH=CH2
B.CH3-CH=CH2和CH3-CH2-CH=CH2
C.CH3-CH3和CH3-CH=CH2
D.CH2= CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
A.电解时以精铜作阳极
B.电解时阴极发生氧化反应
C.粗铜连接电源负极,其电极反应是Cu=Cu2++2e-
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜是我国著名科学家,1933年出版《纯碱制造》一书,创立了中国自己的制碱工艺。其纯碱制造原理如下图所示:

(1)由NaHCO3制备纯碱的化学方程式是_________________。
(2)过程Ⅰ通入NH3和CO2的顺序是__________________。
(3)过程Ⅱ析出NH4Cl(s)的原因是_____________。
(4)充分利用副产品NH4Cl生产NH3和HCl。直接加热分解NH4Cl,NH3和HCl的产率往往很低,原因是________________。
(5)采用MgO循环分解NH4Cl。加热,在300℃以下获得NH3;继续加热至350℃~600℃获得HCl气体。利用下列装置(加热及加持装置略)可测量NH3和HCl的产率。

① 低于300℃时,干燥管盛装的干燥剂是_________。NH3吸收完全后,更换干燥剂和吸收装置中的吸收液。
② 产生NH3的化学反应方程式是_________________。
③ 在350℃~600℃,上图虚线框内应选择的安全瓶是________。

④ MgO可以循环分解NH4Cl制得NH3和HCl的原因是____________(结合化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M 样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g 的M 样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL 和V2 mL(已折算到标准状况下)。

(1)实验1 装置中小试管的作用是_______________。
(2)对于实验2,平视读数前应依次进行的两种操作是:
①______________;②________________________。
(3)实验1 进行实验前,B 瓶中水没有装满,使测得气体体积_____ (填“偏大”、“偏小”或“无影响”,下同);若拆去实验2 中导管a,使测得气体体积_____________。
(4)该实验需要0.50 mol·L-1 的NaOH 溶液470 mL,请回答下列问题
①配制时应称量______g NaOH,配制过程所需仪器____________ (填仪器名称)。
②配制NaOH 溶液时,NaOH 固体中含有Na2O 杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(5)该实验中所用稀硫酸是用98%的浓硫酸(ρ =1.84g/cm3)配制的,若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度_________9.2mol/L(填>、<、=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目拾遗》中在药物名“鼻冲水”条目下写到:贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减。气甚辛烈,触人脑,非有病不可嗅;在“刀创水”条目下写到:治金创,以此水涂伤口,即敛合如故。这里所说的“鼻冲水”、“刀创水”分别指的是
A. 氢氟酸、食盐水 B. 氨水、碘酒 C. 石灰水、硝酸 D. 稀硫酸、食醋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的核外有三个电子层,其最外层电子数是次外层电子数的一半,则该元素位于周期( )
A. 第4周期ⅢA族 B. 第4周期ⅦA族
C. 第3周期ⅣA族 D. 第3周期ⅣB族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com