
【题目】根据元素在元素周期表的位置,判断下列元素都能作为半导体材料的是( )
A. Si K B. C Al C. As Se D. Si Ge
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,向容器的体积为4L的密闭容器中通入1mol N2和3mol H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后。试回答下列问题:
2NH3(g)△H<0,达到平衡后。试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=____________。 达到平衡后,若其它条不变,升高体系的温度,平衡常数K将 (填“增大”、“减小”或“不变”)。
(2)达到平衡后,在恒容条件下,向容器中通入氦气(He),氮气的转化率将_______(“增大”、“减小”或“不变”,下同)。 若再通入1mol N2和3mol H2,氮气的转化率将 。
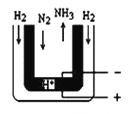
(3)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为
(4)三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是 ;
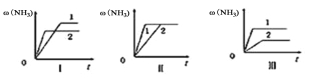
a.图Ⅰ可能是不同温度对反应的影响,且T2>T1
b.图Ⅲ可能是不同压强对反应的影响,且p1>p2
c.图Ⅱ可能是同温同压下,催化剂性能,1>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为 。
(2)锗、砷、硒的第一电离能大小排序为 。
(3)H2SeO3的中心原子杂化类型是 ;SeO32的立体构型是 。与SeO42互为等电体的分子有(写一种物质的化学式即可) 。
(4)H2Se属于 (填:极性或非极性)分子;单质硒的熔点为217℃,它属于 晶体。
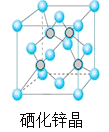
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,若该晶胞密度为ρgcm3,硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为 pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是含碳、氢、氧三种元素的单官能团有机物。A水解得B和C,B可以氧化得到C或D,D氧化得到C。若M(X)表示X的摩尔质量,则下式中正确的是
A.M(A)=M(B)+M(C) B.2M(D)=M(B)+M(C)
C.M(B)< M(D)<M(C) D.M(D)<M(B)<M(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应
X(g)+ Y(g)![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是( )
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数之和与D和F原子最外层电子数之和相等;D和E是相邻两种元素。回答下列问题:
(1)E元素的名称: ;其在元素周期表中的位置是 。
(2)AB2的结构式 ;B的氢化物中原子个数比1:1化合物的电子式 。
(3)A和E元素的最高价含氧酸的酸性较强的是 ;(填化学式)
(4)B、C、D、F四种元素原子半径由大到小的顺序是 (填元素符号),离子半径最小的是 (填离子符号)。
(5)A、B、C三种元素组成原子个数比为nA:nB:nC=1:3:2的化合物,将足量AB2通入该化合物溶液中反应的离子方程式是 。
(6)短周期元素M与D元素位于不同主族,根据对角线规则二者某些性质相似。将M的最高价氧化物溶于C的最高价氧化物对应的水化物溶液中,发生反应的离子方程式为 。
(7)E和F形成的化合物X在高温条件下可以被氢气还原,工业上常用此反应制取高纯度的单质E,写出该化学反应的方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法错误的是( )
A.吸热反应是由于反应物的总能量比生成物的总能量低
B.放热反应的△H>0
C.需要加热才能发生反应不一定是吸热反应
D.酸碱中和反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
(1) 其达到平衡状态的标志是____________________。
①氨的生成速率与氨的分解速率相等
②断开1个N≡N键的同时有6个N—H键生成
③N2、H2、NH3的体积分数不再变化
④气体的总压强不变
⑤N2、H2、NH3分子数之比为1:3:2
⑥N2、H2和NH3的浓度相等
⑦v(N2)=1/3v(H2)
⑧v正(N2)=1/3v逆(H2)
⑨混合物的密度不变
⑩混合物的平均相对分子质量不变
A.①③④⑤⑦⑩ B.①③④⑧⑩
C.①③④⑤⑧⑩ D.全部
(2)从反应开始到达到平衡用N2表示该反应的速率为: mol·L-1·min-1。
(3)平衡时H2的物质的量浓度为 mol·L-1。
(4)H2的转化率是____________。
(5)平衡时混合气体中NH3的体积分数是_______%(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com