
【题目】短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数之和与D和F原子最外层电子数之和相等;D和E是相邻两种元素。回答下列问题:
(1)E元素的名称: ;其在元素周期表中的位置是 。
(2)AB2的结构式 ;B的氢化物中原子个数比1:1化合物的电子式 。
(3)A和E元素的最高价含氧酸的酸性较强的是 ;(填化学式)
(4)B、C、D、F四种元素原子半径由大到小的顺序是 (填元素符号),离子半径最小的是 (填离子符号)。
(5)A、B、C三种元素组成原子个数比为nA:nB:nC=1:3:2的化合物,将足量AB2通入该化合物溶液中反应的离子方程式是 。
(6)短周期元素M与D元素位于不同主族,根据对角线规则二者某些性质相似。将M的最高价氧化物溶于C的最高价氧化物对应的水化物溶液中,发生反应的离子方程式为 。
(7)E和F形成的化合物X在高温条件下可以被氢气还原,工业上常用此反应制取高纯度的单质E,写出该化学反应的方程式 。
【答案】(14分)(1)硅;第三周期第IV族;(2)C=O=C;![]() ;(3)H2CO3;
;(3)H2CO3;
(4)Na>Al>Cl>O;Al3+;(5)CO2+CO32-+2H2O=2HCO3-;
(6)BeO+2OH-=BeO22-+H2O;(7)SiCl4+2H2Si+4HCl↑。
【解析】试题分析:已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍,说明B元素最外层电子数为6,D原子最外层电子数为3,A的次外层电子数为2;C原子内层电子总数是最外层电子数10倍,则C为Na;A、B、D三种元素的原子最外层电子数之和为13,则A的最外层为13-6-3=4,所以A的核外电子数为2+4=6为C元素;A和B原子最外层电子数与D和F原子最外层电子数之和相等,则F的最外层为7,F的原子序数最大,应为Cl元素;D和E是相邻两种元素,D原子最外层电子数为3,所以D为Al元素,E为Si元素;B元素最外层电子数为6,且原子序数比Na,则为O元素,综上可知:A为C元素,B为O元素,C为Na元素,D为Al元素,E为Si元素,F为Cl元素。(1)已知E为Si元素,则其其在元素周期表中的位置是第三周期第IV族;(2)AB2是CO2,其结构式是O=C=O;B的氢化物中原子个数比1:1化合物是H2O2,其电子式是![]() ;(3)A和E元素的非金属性C>Si,所以二者最高价含氧酸的酸性较强的是H2CO3;(4)同一周期的元素,原子序数越大,原子半径越小,不同周期的元素,原子核外电子层数越多,原子半径越大,所以B、C、D、F四种元素原子半径由大到小的顺序是Na>Al>Cl>O;,对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小,因此上述元素形成的离子中,离子半径最小的是Al3+;(5)由A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物为Na2CO3,将足量CO2通入该化合物溶液中反应产生NaHCO3,反应的离子方程式是CO2+CO32-+2H2O=2HCO3-;(6)短周期元素M与D元素位于不同主族,根据对角线规则二者某些性质相似。将M的最高价氧化物溶于C的最高价氧化物对应的水化物溶液中,则M是Be元素,M的最高价氧化物BeO与NaOH溶液发生反应的离子方程式为BeO+2OH-=BeO22-+H2O;(7)E和F形成的化合物X是SiCl4,在高温条件下可以被氢气还原产生Si单质及HCl,工业上常用此反应制取高纯度的单质E,该化学反应的方程式SiCl4+2H2Si+4HCl↑。
;(3)A和E元素的非金属性C>Si,所以二者最高价含氧酸的酸性较强的是H2CO3;(4)同一周期的元素,原子序数越大,原子半径越小,不同周期的元素,原子核外电子层数越多,原子半径越大,所以B、C、D、F四种元素原子半径由大到小的顺序是Na>Al>Cl>O;,对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小,因此上述元素形成的离子中,离子半径最小的是Al3+;(5)由A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物为Na2CO3,将足量CO2通入该化合物溶液中反应产生NaHCO3,反应的离子方程式是CO2+CO32-+2H2O=2HCO3-;(6)短周期元素M与D元素位于不同主族,根据对角线规则二者某些性质相似。将M的最高价氧化物溶于C的最高价氧化物对应的水化物溶液中,则M是Be元素,M的最高价氧化物BeO与NaOH溶液发生反应的离子方程式为BeO+2OH-=BeO22-+H2O;(7)E和F形成的化合物X是SiCl4,在高温条件下可以被氢气还原产生Si单质及HCl,工业上常用此反应制取高纯度的单质E,该化学反应的方程式SiCl4+2H2Si+4HCl↑。


科目:高中化学 来源: 题型:
【题目】在下列物质的溶液中分别加入一定量Na2O2的固体,不会出现浑浊想象的是
A..饱和Na2CO3溶液 B.Ca(HCO3)2稀溶液 C.Na2SO3稀溶液 D.饱和FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
I.分子式的确定:
(1)将一定量有机物A置于氧气流中充分燃烧,实验测得:生成3.6g H2O和8.8g CO2,消耗氧气5.6L(标准状况下),则该物质中各元素的原子个数比是_______________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,由此确定该物质的分子式是______________。
(3)根据价键理论,预测A的可能结构有________种。
II.结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图②。经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用惰性电极电解CuSO4溶液(如图的装置),
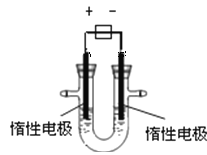
该过程中电解池电极反应式为是阳极: , 阴极: 。
(2)若电解池中装入足量溶液,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为 (假设气体全部逸出)。
(3)欲使电解液恢复到起始状态,应向溶液中加入适量的
A.CuSO4 B.H2O C.CuO D.CuSO4·5H2O
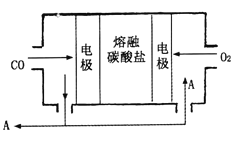
(4)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如右:负极电极反应式为_________________________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
探究浓度对醋酸电离程度的影响
用pH计测定25 ℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)写出醋酸的电离方程式:___________________________________________。
(2)醋酸溶液中存在的微粒有________________________________________。
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是________________________________________________________________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将(填“增大”、“减小”或“不变”)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 稀硫酸 | CaCO3[ | CO2 | NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com