
����Ŀ��A��B��C��D��E��FΪԭ�������������������Ԫ�ء���֪��A�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�B�Ļ�̬ԭ�Ӻ��������7���˶�״̬��B��C��E����Ԫ��ԭ����δ�ɶԵ�����֮��Ϊ3��2��1��Dԭ�Ӻ�����4���ܼ��Ҿ��������ӣ�D��E���γ�DE2�ͻ����Fԭ�Ӻ��������ֻ��1�����ӣ����������������ӡ�
�ش��������⣺
��1��B��C��D����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ (��Ԫ�ط��ű�ʾ)
��2��F�����ڱ���λ�� ������Fͬ������δ�ɶԵ���������Ԫ��Ϊ (��дԪ�ط���)����Ԫ�ؼ۵����Ų�ͼΪ ��
��3��B��E����Ԫ�ؿ��γ�BE3�ͻ������仯ѧʽΪ ������ԭ���ӻ���ʽΪ �����ӵĿռ乹��Ϊ ��
��4��������BA3���ܽ��ڻ�����A2C�У���ԭ���� ��
��5��������DC�۵����DE2���۵㣬ԭ���� ��
���𰸡���1��N��O��Mg��
��2��ds��Cr��![]() ��
��
��3��NCl3��sp3�������ͣ�
��4��NH3������H2O����֮�������γ������
��5��MgO��MgCl2���������ӻ����O2-���Ӱ뾶С��Cl-���Ӱ뾶��MgO�ľ����ܸ���MgCl2��
�����������������A��B��C��D��E��FΪԭ�������������������Ԫ�أ�A�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ���AΪ��Ԫ�أ�B�Ļ�̬ԭ�Ӻ��������7���˶�״̬��Bԭ�Ӻ��������Ϊ7����BΪ��Ԫ�أ�Dԭ�Ӻ�����4���ܼ��Ҿ��������ӣ���������Ų�ʽΪ1s22s22p63s2����DΪMgԪ�أ�B��C��E����Ԫ��ԭ����δ�ɶԵ�����֮��Ϊ3��2��1����C��E��ԭ����δ�ɶԵ������ֱ�Ϊ2��1��C��ԭ���������ڵ���þԪ��֮�䣬��Cԭ�Ӻ�������Ų�ʽΪ1s22s22p4����CΪ��Ԫ�أ�Fԭ�Ӻ��������ֻ��1�����ӣ����������������ӣ�ԭ����������MgԪ�أ���Fԭ�Ӹ��������Ϊ2��8��18��1����FΪCuԪ�أ�E��ԭ����������Mgԭ�ӣ�D��E���γ�DE2�ͻ������EΪ-1�ۣ���Eԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p5����EΪClԪ�ء�
��1��Mg�Ľ�������ǿ����һ��������С��N��Oͬ���ڣ�Nԭ�ӵ�2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ��ʵ�Ԫ�صĵ�һ�����ܹ���Ԫ�صĴ�����Ԫ�صĵ�һ�������ɴ�С��˳��ΪN��O��Mg���ʴ�Ϊ��N��O��Mg��
��2��FΪCuԪ�أ���Χ�����Ų�Ϊ3d104s1�������ڱ�λλ��ds������Fͬ������δ�ɶԵ���������Ԫ�أ�����Χ�����Ų�Ϊ3d54s1��Ϊ24��Ԫ�أ���ΪCr����Ԫ�ؼ۵�����ͼΪ![]() ���ʴ�Ϊ��ds��Cr��
���ʴ�Ϊ��ds��Cr��![]() ��
��
��3��B��E����Ԫ�ؿ��γ�BE3�ͻ�����仯ѧʽΪNCl3������Nԭ�Ӽ۲���Ӷ���=3+![]() ��(51��3)=4��Nԭ�Ӻ��й¶Ե��Ӷ���Ϊ
��(51��3)=4��Nԭ�Ӻ��й¶Ե��Ӷ���Ϊ![]() ��(51��3)=1��Nԭ���ӻ���ʽΪsp3�����ӵĿռ乹��Ϊ�����ͣ��ʴ�Ϊ��NCl3��sp3�������ͣ�
��(51��3)=1��Nԭ���ӻ���ʽΪsp3�����ӵĿռ乹��Ϊ�����ͣ��ʴ�Ϊ��NCl3��sp3�������ͣ�
��4������NH3������H2O����֮�������γ������NH3������H2O�У��ʴ�Ϊ��NH3������H2O����֮�������γ������
��5��MgO��MgCl2���������ӻ����O2-���Ӱ뾶С��Cl-���Ӱ뾶��MgO�ľ����ܸ���MgCl2��MgO���۵���ߣ��ʴ�Ϊ��MgO��MgCl2���������ӻ����O2-���Ӱ뾶С��Cl-���Ӱ뾶��MgO�ľ����ܸ���MgCl2��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ���һ�ַdz���Ҫ���������������ɫ��������ζ��Һ�塣ijУ��ѧ��ȤС����Ҵ��Ľṹ�����ʽ���������̽����������벢��ɶ��й�����Ľ��
���۲���˼����
��1���Ҵ����ӵĺ˴Ź��������� �����շ塣
�����̽����
��2����ͬѧ��С�ձ��м�����ˮ�Ҵ����ٷ���һС������ƣ�Լ�̶������۲�ʵ�����������±��н��۲쵽��ʵ�������۲�����ȫ���ж�������Ⱦ�����٣�������������
ʵ������ | �� �� | |
�� | �Ƴ����Ҵ����� | �Ƶ��ܶȴ����Ҵ� |
�� |
��3����ͬѧ���Թ��м���3��4 mL��ˮ�Ҵ�������50�����ҵ���ˮ�У��ٽ�ͭ˿�������ȣ�Ѹ�ٲ����Ҵ��У�������Ρ����ʱ�Ҵ�������Ӧ�Ļ�ѧ����ʽΪ��������ȩ��____________________________________������֤��ʵ����л�������Խ��������ʢ�� ���Թ��в��ھƾ��ƻ�����ֱ�Ӽ��ȣ��۲����ɣ��˷�Ӧ�Ļ�ѧ����ʽΪ__________________________________________��
�����������ۡ�
��4����ͬѧ��һ֧�Թ��м���3 mL �Ҵ���Ȼ���ҡ���Թܱ���������2 mLŨ�����2 mL�����ᣬ����ͼ��ʾ���Ӻ�װ�ã���ָ����װ�õ���Ҫ������ �������Ҵ������е���ԭ��Ϊ18Oԭ�ӣ������˷�Ӧ��1 8Oԭ�ӽ������������� �У�����ĸ����
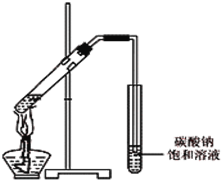
A��ˮ B���������� C��ˮ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������������������������ʹ��NaOH��Һ������ȥ����
A��MgO������Al2O3�� B��Na2CO3������NaHCO3��
C��FeCl2��Һ��CuCl2�� D��Fe2O3������SiO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܣ���������ƿ�����������ʷ������
A. �٢ۢ� B. �ڢޢ� C. �٢ܢ� D. �ܢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣�A��B��C��Ϊ������Ԫ�أ�A��C����Ԫ�ص�ԭ�Ӻ��������֮�͵���B����������B��ԭ�Ӻ�������������������ȡ��ش�
![]()
��1��д��Ԫ�ط��ţ�A ��B ��C ��
��2��C��ԭ�ӽṹʾ��ͼ�� ��B������������Ӧˮ����Ļ�ѧʽΪ ��
��3��A���⻯���ˮ��Һ�� ���������������������ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2SO4��NaCl��NaOH�Ļ����Һ�У�����Na+��SO42-��OH-�ĸ�����8:1:2������Һ��Na2SO4��NaCl��NaOH������Ϊ�� ��
A. 1:1:1 B. 1:4:2 C. 1:2:4 D. 1:3:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������X��Y��Z��M��N�����ǵ������ӿ�����SO42����Cl����![]() ��CO32���������ӿ�����Ag+��NH4+��Na+��Al3+��Cu2+��Ba2+��Fe3+����֪��
��CO32���������ӿ�����Ag+��NH4+��Na+��Al3+��Cu2+��Ba2+��Fe3+����֪��
��M����ɫ��Ӧ�ʻ�ɫ��
�������ξ�����ˮ��ˮ��Һ��Ϊ��ɫ��
��X����Һ�����ԣ�Y��Z��N����Һ�����ԣ�M����Һ�ʼ��ԡ�
�������������ε���Һ�зֱ����Ba(NO3)2��Һ��ֻ��X��Z����Һ������������
�������������ε���Һ�У��ֱ���백ˮ��N��Z����Һ�����ɳ����������Ӱ�ˮ��Z�г�����ʧ��
����X����Һ�ֱ���뵽Y��Z��N����Һ�У��������ɲ�����ϡ����ij�����
��ش��������⣺
��1���������У�������������ͬ�������εĻ�ѧʽ��__________________
��2��M��Һ�Լ��Ե�ԭ����(�����ӷ���ʽ��ʾ)____________________________
��3��X��Z����Һ��Ӧ�����ӷ���ʽ��_______________________________________
��4��N������ˮ��Ӧ�����ӷ���ʽ��___________________________
��5����Ҫ����Y�������������ӣ���ȷ��ʵ�鷽����___________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ�����ˮ��Һ�д���������ǣ� ��
A��Na+��Ba2+��SO42����Cl��
B��Mg2+��K+��Cl����NO3��
C��H+��K+��CO32����NO3��
D��Ag+��Ca2+��Cl����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������̼����ȼ�ϵ��ԭ��ʾ����ͼ�������йظõ�ص�˵����ȷ����

A����ӦCH4+H2O![]() 3H2+CO��ÿ����1molCH4ת��12mol����
3H2+CO��ÿ����1molCH4ת��12mol����
B���缫A��H2����ĵ缫��ӦΪ��H2+ 2OH��-2e-=2H2O
C����ع���ʱ,CO32-��缫B�ƶ�
D���缫B�Ϸ����ĵ缫��ӦΪ��O2+2CO2+4e-=2CO32-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com