
【题目】一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159g/cm3 , 熔点为﹣97.73℃,沸点为﹣24.2℃,18℃时在水中的溶解度为280mL/mL水,与乙醚、丙酮或苯互溶,能溶于乙醇.在实验室里可用下图装置制造一氯甲烷:制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸. 
试填写下列空白:
(1)制备一氯甲烷的化学方程式 , 其反应类型属于反应;
(2)装置b的作用是;
(3)已知卤代烃能发生碱性水解,转化为醇.装置e中可能发生的反应方程为 .
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(燃烧产物中含氯产物只有HCl).则CH3Cl燃烧的化学方程式是;
(5)实验中实际按甲醇和浓盐酸1:2(物质量之比)进行反应的理由是;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是 .
【答案】
(1)CH3OH+HCl ![]() CH3Cl+H2O;取代
CH3Cl+H2O;取代
(2)防止倒吸,保证安全
(3)CH3Cl+NaOH ![]() CH3OH+NaCl;NaOH+HCl=NaCl+H2O
CH3OH+NaCl;NaOH+HCl=NaCl+H2O
(4)2CH3Cl+3O2 ![]() 2CO2+2H2O+2HCl
2CO2+2H2O+2HCl
(5)可使甲醇充分反应,转化成一氯甲烷
(6)醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出
【解析】解:从左向右的实验仪器作用分别为:制取一氯甲烷,防倒吸,排水法收集一氯甲烷气体,接收排水集气体时排出的水,尾气吸收;(1)制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸,故该实验中的一氯甲烷应该用甲醇和浓盐酸制得,反应的化学方程式为:CH3OH+HCl ![]() CH3Cl+H2O,该反应为取代反应,故答案为:CH3OH+HCl
CH3Cl+H2O,该反应为取代反应,故答案为:CH3OH+HCl ![]() CH3Cl+H2O;取代;(2)由于氯化氢极易挥发,而氯化氢又极易溶解在水中,所以装置b的作用是防止倒吸,保证安全,故答案为:防止倒吸,保证安全;(3)浓盐酸易挥发,卤代烃能发生水解,生成乙醇和氯化氢,装置e为尾气吸收装置,吸收的为氯化氢气体,发生的反应为:NaOH+HCl=NaCl+H2O;一氯甲烷还能够与氢氧化钠酸溶液反应生成甲醇和氯化钠,反应的化学方程式为:CH3Cl+NaOH
CH3Cl+H2O;取代;(2)由于氯化氢极易挥发,而氯化氢又极易溶解在水中,所以装置b的作用是防止倒吸,保证安全,故答案为:防止倒吸,保证安全;(3)浓盐酸易挥发,卤代烃能发生水解,生成乙醇和氯化氢,装置e为尾气吸收装置,吸收的为氯化氢气体,发生的反应为:NaOH+HCl=NaCl+H2O;一氯甲烷还能够与氢氧化钠酸溶液反应生成甲醇和氯化钠,反应的化学方程式为:CH3Cl+NaOH ![]() CH3OH+NaCl,故答案为:CH3Cl+NaOH
CH3OH+NaCl,故答案为:CH3Cl+NaOH ![]() CH3OH+NaCl;NaOH+HCl=NaCl+H2O;(4)根据一氯甲烷的组成元素可知,一氯甲烷燃烧的生成物应该是CO2、水和氯化氢,则CH3Cl燃烧的化学方程式是:2CH3Cl+3O2
CH3OH+NaCl;NaOH+HCl=NaCl+H2O;(4)根据一氯甲烷的组成元素可知,一氯甲烷燃烧的生成物应该是CO2、水和氯化氢,则CH3Cl燃烧的化学方程式是:2CH3Cl+3O2 ![]() 2CO2+2H2O+2HCl,故答案为:2CH3Cl+3O2
2CO2+2H2O+2HCl,故答案为:2CH3Cl+3O2 ![]() 2CO2+2H2O+2HCl;(5)根据CH3OH+HCl
2CO2+2H2O+2HCl;(5)根据CH3OH+HCl ![]() CH3Cl+H2O知:甲醇和浓盐酸1:1(物质量之比)反应恰好反应,而实际按甲醇和浓盐酸1:2(物质量之比)进行反应,显然盐酸是过量的,目的应该是增加一种反应物(浓盐酸)的量,提高另一反应物(甲醇)的转化率,使甲醇充分反应,转化成一氯甲烷;故答案为:可使甲醇充分反应,转化成一氯甲烷;(6)根据已知条件可知,甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出,所以收集到一定体积的气体产物所消耗的甲醇、浓盐酸的混和溶液的量比正常情况下多;故答案为:甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出.
CH3Cl+H2O知:甲醇和浓盐酸1:1(物质量之比)反应恰好反应,而实际按甲醇和浓盐酸1:2(物质量之比)进行反应,显然盐酸是过量的,目的应该是增加一种反应物(浓盐酸)的量,提高另一反应物(甲醇)的转化率,使甲醇充分反应,转化成一氯甲烷;故答案为:可使甲醇充分反应,转化成一氯甲烷;(6)根据已知条件可知,甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出,所以收集到一定体积的气体产物所消耗的甲醇、浓盐酸的混和溶液的量比正常情况下多;故答案为:甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出.
(1)根据制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸可知制备一氯甲烷的原理,据此写出反应的化学方程式;(2)由于氯化氢极易挥发,而氯化氢又极易溶解在水中,所以装置b的作用是防止倒吸,保证安全;(3)卤代烃能发生碱性水解,转化为醇,由于在生成醇的同时,还生成氯化氢,则最终e中发生的反应有:一氯甲烷与氢氧化钠溶液反应、氯化氢与氢氧化钠溶液反应;(4)根据一氯甲烷的组成元素可知,一氯甲烷燃烧的生成物应该是CO2、水和氯化氢;(5)实际按甲醇和浓盐酸1:2(物质量之比)进行反应,显然盐酸是过量的,目的应该是增加一种反应物(浓盐酸)的量,提高另一反应物(甲醇)的转化率;(6)甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出,使实际产量少.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的量的说法中正确的是( )
A.物质的量就是物质的质量B.摩尔是国际单位制中的基本单位
C.某容器中含有1mol氯D.阿伏加德罗常数是6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是
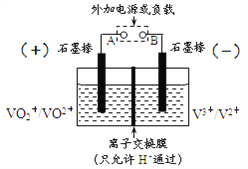
A. 放电时,右槽发生还原反应
B. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C. 充电时,每转移1mol电子,n(H+)的变化量为1mol
D. 充电时,阴极电解液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,固定容积的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g),达到化学平衡状态的标志是
2SO3(g),达到化学平衡状态的标志是
①n(SO2):n(O2):n(SO3) =2:1:2 ②SO2的浓度不再发生变化 ③容器中的压强不变
④单位时间内生成nmolSO3,同时生成2nmolO2 ⑤混合气体的平均相对分子质量不变
A. ①④⑤ B. ①②④ C. ②③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的组成、性质的说法,正确的( )
A.天然气、液化石油气的成分相同
B.葡萄糖、淀粉和乙酸乙酯在一定条件下都能发生水解反应
C.淀粉、蛋白质均属于高分子化合物,而油脂不属于高分子化合物
D.石油的裂解是化学变化,而石油的分馏和煤的干馏都是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知由某一元芳香羧酸与甲醇生成的酯.取0.68g该酯与40mL 0.2mol/L的NaOH溶液混合加热,使其完全水解后,再用0.2mol/L的盐酸中和剩余的碱,耗去15mL盐酸.另取27.2g该酯,完全燃烧后得到70.4gCO2和14.4g水.求:
(1)该酯的最简式;
(2)该酯的相对分子质量;
(3)该酯的结构简式的名称.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下向2L的恒温密闭容器中投入2mol A和1mol B,发生可逆反应 3A(g)+2B(s)2C(g)+D(g)△H=﹣a kJ/mol.5min后达平衡,测得容器中n(C)=0.8mol.则下列说法正确的是( )
A.3v(A)=2v(C)=0.16 mol/(Lmin)
B.该可逆反应达平衡后,放出0.8a kJ的热能(假设化学能全转化为热能)
C.升高温度,该平衡正向速率减小,故平衡逆向移动
D.使用催化剂或缩小容器体积,该平衡均不会移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的叙述正确的是
A. 通常情况下氯气比空气重,可以用向上排空气法收集Cl2
B. 氯气是一种无色无味气体,气体泄露时不易被发现
C. 液氯说明常温常压下也存在液态氯气
D. 液氯可存贮于钢瓶中,因此氯水也可贮存于钢瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境,必须进行处理。某工厂的处理工艺流程如下:
![]()
(1)N2H4的电子式为___________。
(2)下列溶液中,可以代替上述流程中N2H4的是___________。(填选项序号)
A.FeSO4溶液 B.浓HNO3溶液 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为___________。
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬酸性废水中存在着Cr2O72-和CrO42-相互转化的平衡,请用离子方程式表示它们之间的转化反应___________;
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为____________写化学式)。
(5)工业上可用电解法来处理含Cr2O![]() 的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O
的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O![]() 还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。
还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是________(填“铁”或“石墨”)。
②上述处理过程中,Cr2O![]() 被还原成Cr3+的离子方程式为_______________________。
被还原成Cr3+的离子方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com