
| A、0.04mol |
| B、0.05mol |
| C、0.06mol |
| D、0.07mol |
| m |
| M |
| 4.8g |
| 96g/mol |
| 2 |
| 3 |
| 2 |
| 3 |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、K+、Al3+、NO3-、AlO2- |
| B、K+、H+、MnO4-、SO42- |
| C、Ba2+、Cl-、Na+、OH- |
| D、Fe2+、H+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
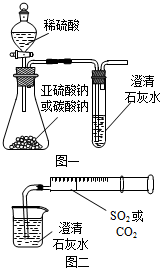 某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象.经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快.
某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象.经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中,水的电离平衡向右移动 |
| B、加水稀释100倍后,溶液的pH=5 |
| C、加入CH3COONa固体,水的离子积常数Kw变小 |
| D、加入冰醋酸,醋酸的电离程度变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用铂电极电解氯化镁溶液:Cl-+2H2O
| ||||
| B、NaHSO4溶液中滴人Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-═BaSO4↓+H2O | ||||
| C、在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | ||||
| D、稀HNO3中加入过量的Fe粉:Fe十4H+十NO3-═Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com