
| A. | 该反应为吸热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中含δ键又含π键 | D. | 每生成1.8gH2O消耗2.24LO2 |
分析 A、根据大多数放热反应在常温下能进行来回答;
B.根据不同种元素形成的共价键为极性键来回答;
C.根据根据一个单键就是一个δ键,一个双键就是一个δ键,一个π键,结合物质的结构来判断;
D.根据气体的体积与温度、压强有关来判断.
解答 解:A、该反应在室温下可以进行,故该反应为放热反应,故A错误;
B、二氧化碳结构为O=C=O,为极性键,故B错误;
C、甲醛中,含有碳氧双键以及两个碳氢单键,故其中3个δ键,1个π键,故C正确;
D、每生成1.8gH2O消耗氧气的物质的量为0.1,没有标明状况,故不一定为2.24L,故D错误;
故选C.
点评 本题以除甲醛气体为新的情境,考查了化学反应基本理论和基本概念,涉及化学反应中能量变化,分子结构、化学键以及气体的体积等相关知识.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(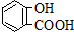 ) ) |
| 电离平衡常数(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于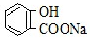 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和  溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→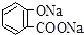 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1的原因之一是能形成分子内氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
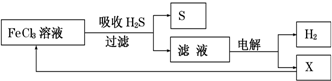
| A. | 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+ | |
| B. | 电解时选用阴离子交换膜,电解过程中的阳极区反应主要为:2Cl--2e-=Cl2 | |
| C. | 电解过程中若阴极产生2.24L气体,则阳极区产生0.2mol Fe3+ | |
| D. | 实验室可用点燃充分燃烧的方法消除H2S污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是 .
.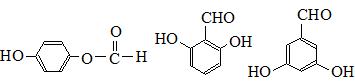 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com