
【题目】硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。某研究小组设计制备SnSO4与SnCl4路线如下。完成下列填空:
(一)制备SnSO4
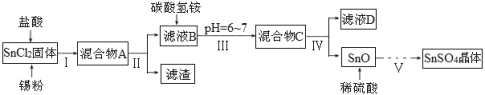
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
(1)SnCl2用盐酸进行酸溶的原因是_____________________。
(2)步骤Ⅱ中用到的玻璃仪器除烧杯外还有____________;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为______________。
(3)步骤Ⅴ依次操作:蒸发浓缩、_________、_________、洗涤、低温干燥,即可得到产物。
(二)制备SnCl4
实验室用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。实验装置如图所示:
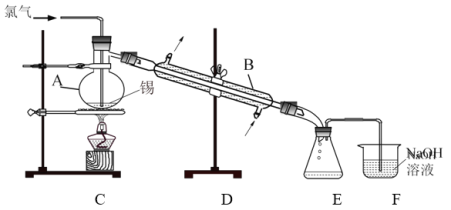
(4)仪器B的名称______________。
(5)图中尾气处理装置不够完善,改进的方法是:________________(可以画图,也可以用文字表述,需注明仪器、试剂及连接位置等)。
(6)若反应中用去锡粉11.9 g,反应后在锥形瓶中收集到23.8 g SnCl4,则SnCl4的产率为__________。
【答案】抑制Sn2+的水解 漏斗、玻璃棒 取最后一次洗涤液,加入硝酸酸化的AgNO3溶液,如果没有出现沉淀,说明洗涤干净,如果出现沉淀,说明没有洗涤干净 冷却结晶 过滤 冷凝管 E、F之间连装有碱石灰的干燥管 91.2%
【解析】
由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢铵,调节溶液pH=6~7,使Sn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,蒸发浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NH4Cl等,据此分析;
(一)(1)加入盐酸,抑制Sn2+水解;
(2)步骤Ⅱ为过滤;沉淀为SnO表面附着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-;
(3)步骤Ⅴ是用硫酸溶解后,从溶液中获得晶体,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,制得SnSO4晶体;
(二)(1)仪器B的名称为冷凝管;
(2)由信息可知SnCl4遇水水解,F中氢氧化钠溶液中水蒸气易挥发进入E中;
(3)根据产率=![]() ×100%,据此解答即可。
×100%,据此解答即可。
(一)(1)SnCl2是强酸弱碱盐,在溶液中Sn2+易发生水解反应使溶液显酸性。加入盐酸,抑制Sn2+水解;
②步骤Ⅱ为过滤,用到的玻璃仪器除烧杯外还有漏斗、玻璃棒,步骤IV是分离难溶性固体与溶液的方法,是过滤,步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净,使用的试剂是硝酸、硝酸银溶液,具体方案为:取最后一次洗涤液,加入硝酸酸化的硝酸银,如果没有出现沉淀,说明洗涤干净,如果出现沉淀,说明没有洗涤干净;
(3)步骤Ⅴ是用硫酸溶解SnO后,得到SnSO4溶液,从溶液中获得晶体,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,制得SnSO4晶体;
(二)(1)根据仪器结构可知仪器B为冷凝管;
(2)E收集产品,F中氢氧化钠溶液中水蒸气易挥发,沿导气管进入E中,易使SnCl4水解,所以改进的措施是在E和F之间增加干燥装置可以避免此种情况发生;
(3)11.9 g Sn粉的物质的量n(Sn)=![]() =0.1 mol,故根据Sn元素守恒可知应生成SnCl4极的物质的量为0.1 mol,其质量m(SnCl4)=0.1 mol×(119+4×35.5) g/mol=26.1 g,其产率=
=0.1 mol,故根据Sn元素守恒可知应生成SnCl4极的物质的量为0.1 mol,其质量m(SnCl4)=0.1 mol×(119+4×35.5) g/mol=26.1 g,其产率=![]() ×100%≈91.2%。
×100%≈91.2%。


科目:高中化学 来源: 题型:
【题目】按要求填空
(1)NH4Cl溶液呈酸性,用离子方程式表示其原因___________________________________;
(2)25℃时1g甲烷完全燃烧生成二氧化碳气体和液态水,放出56千焦的热量,写出该反应的热化学方程式:_____________________________ ;
(3)铁在空气中发生吸氧腐蚀时的正极反应方程式:_________________________________
(4)硫酸铜溶液通电时发生的化学反应方程式:_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质( )

A. A是C3H6;B是C6H6
B. A是C2H6;B是C3H6
C. A是C2H6;B是C6H6
D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了以Ni / Al2O3 为催化剂,由CO2和H2转化为产品CH4的反应历程,其示意图如下:

下列说法不正确的是
A. 总反应方程式为:CO2+4H2![]() CH4+2H2O
CH4+2H2O
B. 催化剂可有效提高反应物的平衡转化率
C. 在反应历程中,H―H键与C=O键断裂吸收能量
D. 反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。完成下列填空:
(1)写出一个包含上述七种物质的氧化还原反应方程式,配平并标出电子转移方向和数目:___________________________。
(2)上述反应中,氧化剂是_____________,每转移1 mol电子,生成Cl2_____ L(标准状况)。
(3)在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。写出该实验中涉及反应的离子反应方程式:_________________。
(4)根据以上实验,写出两个反应中氧化剂、氧化产物的氧化性强弱顺序__________。
(5)上述氧化还原反应体系中,属于第三周期元素的简单离子半径由大到小的顺序为________
(6)氯原子的最外层电子的轨道式为___________,氯原子核外有_______不同运动状态的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工基础原料。用乙烯合成光学树脂CR-39单体的过程如下:
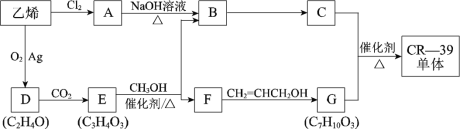
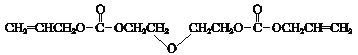
已知:i.CR-39单体结构简式是:
ii.酯与醇有如下反应:![]()
(1)乙烯转化为A的反应类型是___________。
(2)在D、E的分子中,都只有一种化学环境的氢原子。 D的结构简式是__________。E为五元环状化合物,E与CH3OH反应的化学方程式是_____________。
(3)G与足量NaOH溶液反应的化学方程式是________________。
(4)F的一种同分异构体K,其分子中不同化学环境的氢原子个数比是3∶1∶1∶1,且能与NaHCO3反应。
①K能发生消去反应,生成的有机物的结构简式是______________ 。
②K在一定条件下合成高分子化合物的化学方程式是_______________。
(5)下列有关C的叙述正确的是(填写序号)_______。
a. 能与乙酸发生酯化反应 b. 能与乙醇发生酯化反应
c. 1 mol C最多能与2 mol Na反应 d. C的同分异构体不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的氧化剂,铁、铜是生活中常见的金属.
(1)Fe与Cu混合物与65%的硝酸反应会产生大量NO2,该反应使用的硝酸的物质的量浓度为______mol/L(已知ρ=1.4g/cm3).
(2)各为0.1mol的Cu与Fe混合物与足量的某浓度的硝酸反应产生4.48L气体(标准状况下),则该反应消耗的硝酸为______mol.
(3)4.4gFe与Cu混合物与过量的硝酸反应,放出的气体与标准状况下的1.12L的氧气混合后通入水中恰好被完全吸收,则其中铜的质量为______g.
(4)Fe与Cu混合物共有a mol,其中铜的物质的量分数为X,将该混合物全部投入b mol的硝酸中使其充分反应,假定硝酸的还原产物仅有NO,
①若溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是______(用a、x表示).
②若x=0.2时,溶液Fe2+与Fe3+的物质的量相等时,在标准状况下产生NO 6.72L,求a、b的值.(写出简要的计算过程)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图示实验设计和操作合理的是( )
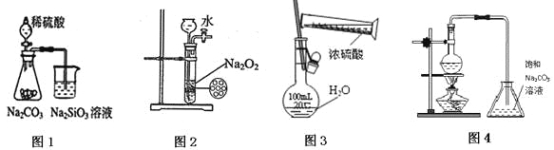
A.图1 证明非金属性强弱:S>C>SiB.图2 制备少量氧气
C.图3 配制一定物质的量浓度的硫酸溶液D.图4 制备少量乙酸丁酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com