



科目:高中化学 来源: 题型:
| A、S |
| B、H2S |
| C、SO2 |
| D、SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫具有漂白性,可广泛用于食品的增白 |
| B、可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| C、碘是人体必须微量元素,所以食盐中常加入适量KIO3 |
| D、侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
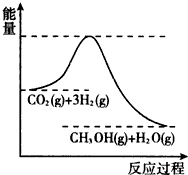
科目:高中化学 来源: 题型:
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 名称 | 丁烷与 2--甲基丙烷 | 红磷 与白磷 | 庚烷与 十六烷 | 氯仿与 三氯甲烷 | 氕与 氘、氚 |
| 相互 关系 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com