
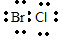 不同元素的原子之间形成的化学键是极性共价键,形成极性分子;
不同元素的原子之间形成的化学键是极性共价键,形成极性分子;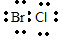 ;共价;极性.
;共价;极性.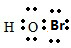 ,故答案为:
,故答案为: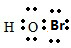 ;
;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、pH=2的盐酸与pH=12的氨水等体积混合:c(NH4-)=c(Cl-)>c(H+)=c(OH-) |
| B、0.2 mol?L-1的CH3COONa溶液与0.1 mol?L-1的HCl等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
| C、相同物质的量浓度时,溶液中c(NH4+)由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3?H2O |
| D、0.1 mol?L-1的HCN(弱酸)和0.1 mol?L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 12 |
| ② | 22.00 | 18.00 | 11 |
| ③ | 22.00 | 22.00 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W、Q五种短周期元素在周期表中的位置如下表,其中Y与Z的质子数之和比Q的质子数多1.
X、Y、Z、W、Q五种短周期元素在周期表中的位置如下表,其中Y与Z的质子数之和比Q的质子数多1.| X | Y | Z | |
| W | Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com