
| V |
| Vm |
| n |
| V |
| V |
| Vm |
| 0.224L |
| 22.4L/mol |
| 0.02mol |
| 0.01L |
| 0.336L |
| 22.4L/mol |
| 2.7g |
| 1.0g |


科目:高中化学 来源: 题型:
| A、甲>乙>丙 |
| B、甲=乙=丙 |
| C、乙>甲>丙 |
| D、甲>丙>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、2.7 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24L |
| B、3.36L |
| C、1.68L |
| D、5.04L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、尝一尝自来水有没有咸味 |
| B、先加稀HCl,后加入AgNO3溶液,看有无白色沉淀 |
| C、加入AgNO3溶液,再加入足量稀HNO3,看有无白色沉淀 |
| D、直接加入AgNO3溶液,看有无白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
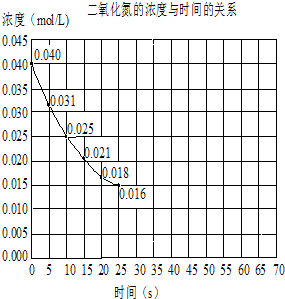 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L.如图中的曲线表示二氧化氮分解反应在前25s内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L.如图中的曲线表示二氧化氮分解反应在前25s内的反应进程.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com