
分析 (1)被还原的硝酸生成NO2或NO2、NO混合物,根据N元素守恒计算被还原硝酸的物质的量;
(2)设混合物中Cu、Ag物质的量分别为xmol、ymol,产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2xmol、ymol,根据合金质量及N原子守恒列方程,再根据m=nM计算Ag的质量,进而计算合金中银的质量分数.
解答 解:(1)被还原的硝酸生成NO2或NO2、NO混合物,根据N元素守恒,被还原的硝酸的物质的量为:n(HNO3)=n(气体)=6.72 L÷22.4L/mol=0.3mol,
答:被还原的硝酸的物质的量为0.3mol;
(2)反应的n(HNO3)=13.5 mol/L×0.08L-1 mol/L×0.08L=1 mol
设合金中铜、银物质的量分别为xmol、ymol,则:64x+108y=30
产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2x mol、y mol,据N守恒可得:2x+y+0.3=1,
联立方程,解得:x=0.3、y=0.1,
故合金中银的质量为:0.1 mol×108g/mol=10.8g,
合金中Ag的质量分数为:$\frac{10.8g}{30g}$×100%=36.0%,
答:合金中银的质量质量分数为36.0%.
点评 本题考查混合物反应的计算、氧化还原反应计算,题目难度中等,明确反应中硝酸起氧化剂、还原剂作用为解答关键,注意掌握质量守恒在化学计算中的应用方法.


科目:高中化学 来源: 题型:推断题
 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X是
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X是查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1:4 | B. | 1:1:1:1 | C. | 1:2:1:2 | D. | 2:2:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
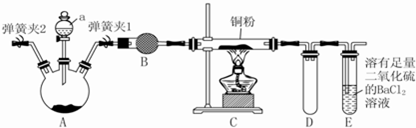
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
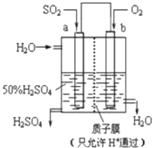
| A. | a为正极,b为负极 | |
| B. | 生产过程中H+向a电极区域运动 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:2H2+SO2-2e-=SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HCl>H2S>H2O | B. | 酸性:HClO4>HNO3>H3PO4 | ||
| C. | 还原性:HCl>HBr>HI | D. | 碱性:NaOH>Mg(OH)2>Ba(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com