
 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X是
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X是分析 (1)若甲和X均为非金属单质,符合关系的物质为:甲为O2,X为C,乙为CO2,丙为CO;
(2)若甲为气体单质,X为固体单质,乙和X在溶液中进行得到丙,说明甲为氯气,X为铁,乙为氯化铁,丙为氯化亚铁,据此判断;
(3)若甲是焰色反应为黄色的化合物说明为钠的化合物,X是引起温室效应的一种气体为二氧化碳,则甲为氢氧化钠,乙为碳酸钠,丙为碳酸氢钠;
解答 解:(1)若甲和X均为非金属单质,反应的化学方程式为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,CO2+C$\frac{\underline{\;点燃\;}}{\;}$2CO,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,符合关系的物质为:甲为O2,X为C,乙为CO2,丙为CO,
故答案为:C;O2;
(2)3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,2FeCl3+Fe=3FeCl2,2FeCl2+Cl2=2FeCl3,说明甲为Cl2,X为Fe,乙为FeCl3,丙为FeCl2,
故答案为:Cl2; Fe;
(3)若甲是焰色反应为黄色的化合物说明为钠的化合物,X是引起温室效应的一种气体为二氧化碳,则甲为氢氧化钠,乙为碳酸钠,丙为碳酸氢钠,乙溶液通入X气体生成丙的离子方程式为:CO32-+CO2+H2O=2HCO3-,
故答案为:CO32-+CO2+H2O=2HCO3-;
点评 本题考查无机物的推断,为高频考点,把握转化关系图中的连续反应及物质的性质为解答的关键,侧重物质性质及发生的化学反应的考查,选项D中的相互促进水解反应生成沉淀为解答的难点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 葡萄糖 | B. | 甲酸乙酯 | C. | 乙酸乙酯 | D. | 蔗糖(C12H22O11) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | NaHCO3溶液中:c(OH-)+c(H2CO3)=c(H+)+c(CO32-) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl固体 | B. | Zn粉 | C. | SO3固体 | D. | CuSO4晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;
;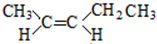 和
和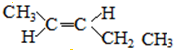 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com