
| A. | 碘化氢的分解 | B. | 生石灰的熔化 | C. | 氯化钠的熔化 | D. | 酒精的蒸发 |
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 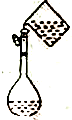 配置一定物质的量浓度的溶液 | B. | 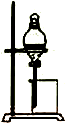 用CCl2萃取碘水中的溴 | ||
| C. | 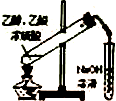 制备乙酸乙酯 | D. | 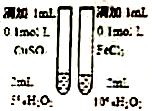 比较不同催化剂对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X是
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X是查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子层数逐渐增多 | B. | 原子半径逐渐增大 | ||
| C. | 最高正化合价数值逐渐增大 | D. | 从硅到氯负价从-1→-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的溴(碘化钾溶液) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 乙酸乙酯中的乙酸(饱和碳酸钠溶液) | D. | 苯中的甲苯(溴水) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
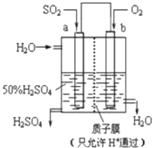
| A. | a为正极,b为负极 | |
| B. | 生产过程中H+向a电极区域运动 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:2H2+SO2-2e-=SO42-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com