
| A. | SO32- | B. | SO42- | C. | S | D. | H2S |
分析 SO2中S元素化合价是+4价,属于中间价态,即可作氧化剂又可作还原剂;当它作还原剂时,反应中得到电子化合价降低被氧化,则产物中化合价大于+4,据此进行解答.
解答 解:A.SO32-中S的化合价为+4,与二氧化硫的化合价相同,不是二氧化硫的氧化产物,故A错误;
B.SO42-中S的化合价为+6,可以是SO2参加反应作还原剂被氧化的产物,故B正确;
C.S的化合价为0价,是SO2参加反应作氧化剂被还原的产物,故C错误;
D.H2S中S的化合价为-2价,是SO2参加反应作氧化剂被还原的产物,故D错误;
故选B.
点评 本题考查氧化还原反应,题目难度不大,明确氧化还原反应的实质为解答关键,注意掌握氧化剂与还原剂、氧化产物与还原产物概念及判断方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
 ;液溴的保存通常采取的方法是水封在棕色瓶中,密闭保存.
;液溴的保存通常采取的方法是水封在棕色瓶中,密闭保存.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基、甲基电子数相同 | |
| B. | 所有烃基和苯基都不是官能团 | |
| C. | 甲醛和一氯甲烷在常温下呈气态,而溴乙烷、苯甲酸、饱和高级脂肪酸甘油酯在常温 下呈液态 | |
| D. | 不含羟基和羧基的有机物水溶性都较差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2能与大多数金属反应 | |
| B. | N2是大气中的主要成分之一,雷雨时可直接转化为NO2 | |
| C. | 硫是一种黄色的能溶于水的晶体,既有氧化性又有还原性 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯气、水、碘(I2)在标准状况下所含分子数相等 | |
| B. | 在非标准状况下,1mol任何气体的体积不可能是22.4L | |
| C. | 同温同压下两种气体,只要它们的分子数相同,所占体积几乎相同 | |
| D. | 1mol气体的体积不一定是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应时所用的酸略过量 | B. | 反应后溶液中c( H+)=c( A-) | ||
| C. | 反应后生成的盐不水解 | D. | 参加反应的酸和碱的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
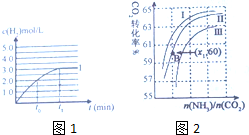 氨气是一种重要的化工产品,在生产和科研中应用广泛,氨气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:
氨气是一种重要的化工产品,在生产和科研中应用广泛,氨气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:| 弱电解质 | 化学式 | 电离常数(K) |
| 氨水 | NH3•H2O | 1.79×10-5 |
| 碳酸 | H2CO3 | K1=4.30×10-7 |
| K2=5.61×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com