
| A. | 普通玻璃和钢化玻璃的成分不一样,钢化玻璃中加了玻璃钢 | |
| B. | 水泥的主要成分是硅酸二钙、硅酸三钙和铝酸三钙 | |
| C. | 水泥具有水硬性,因此在保存和运输过程中要注意防水防潮 | |
| D. | 陶瓷的釉料在烧制时,若空气过量,一般显示的是高价态的金属的颜色 |
分析 A.钢化玻璃是将普通玻璃加热软化后,迅速冷却后得到的;
B.依据水泥成分解答;
C.水泥遇到水变硬,失效;
D.空气过量金属被氧化生成高价态物质.
解答 解:A.钢化玻璃是将普通玻璃加热软化后,迅速冷却后得到的,成分与普通玻璃一样,故A错误;
B.水泥的主要成分是硅酸二钙、硅酸三钙和铝酸三钙,故B正确;
C.水泥具有水硬性,因此在保存和运输过程中要注意防水防潮,故C正确;
D.陶瓷的釉料在烧制时,若空气过量,金属被氧化生成高价态物质,显示的是高价态的金属的颜色,故D正确;
故选:A.
点评 本题考查了玻璃、水泥、陶瓷的制备和性质,明确三种物质的制备过程及成分和性质即可解答,题目难度不大,注意对相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 2s时物质A的转化率为70% | |
| B. | 达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K也减小 | |
| C. | 达到平衡状态时,增加A物质的量,A和B转化率都提高 | |
| D. | 当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.
如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 铁器在潮湿的空气中生锈 | D. | NaHCO3转化为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
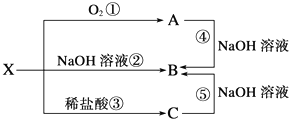
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=0.1mol/L的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | c(Fe2+)=0.1mol/L的溶液:H+、Al3+、NO3-、SCN- | |
| D. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com