
【题目】在一定条件下,对于反应mA(g)+nB(g) ![]() cC(g)+dD(g),C物质的质量分数(C%)随温度升高或压强增大而减小。下列判断正确的是
cC(g)+dD(g),C物质的质量分数(C%)随温度升高或压强增大而减小。下列判断正确的是
A. 该反应为放热反应
B. (m+n) >(c+d)
C. 减小压强,平衡正向移动,平衡常数K值增大
D. 达到平衡后,增加A的物质的量,平衡正向移动,A的转化率增大
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 从1L 1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 40g NaOH溶于1L的水中所得的溶液中NaOH物质的量浓度是1mol·L-1
C. 0.5L 2mol·L-1 BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 制成0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
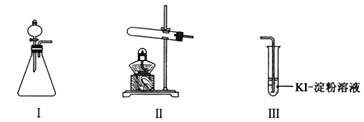
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)_____________________造成的,请设计实验证明他们的猜想是否正确。_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,浓度均为0.2 mol/L 的NaHCO3 和Na2CO3 溶液中,下列判断不正确的是
A. 均存在电离平衡和水解平衡
B. 存在的粒子种类相同
C. c(OH-)前者大于后者
D. 分别加入少量NaOH固体,恢复到原温度,pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和氨水溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定氢氧化钠溶液的曲线
B. 滴定氨水的过程应该选择酚酞作为指示剂
C. b点溶液中:c(H+)>c(OH-)+c(NH4+)+c(NH3·H2O)
D. a、b、c、d四点的溶液中,水的电离程度最大的是c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。完成合成氨工业中有关问题。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①高温高压、催化剂条件下,工业合成氨的热化学方程式为:____________________________________________。
②若起始时向容器内放入0.2 mol N2和0.6 mol H2,达到平衡后放出的热量为Q,则Q值______18.44 kJ(填“﹥”“=”或“﹤”)。
(2)NH3(g)与CO2(g) 经过两步反应合成尿素(CO(NH2)2),两步反应的能量变化示意图如下:
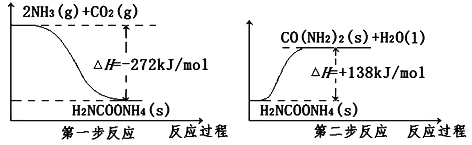
①则2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
②在一定温度和压强下,若①中的反应,NH3和CO2的物质的量之比(氨碳比)n(NH3)/n(CO2)=x。下图是氨碳比(x)与CO2平衡转化率(α)的关系。

α随着x增大而增大的原因是_________________________________。
③图中B点处,NH3的平衡转化率_______________。
(3)将N2和H2各1 mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中,N2的体积分数将_______________(填序号)。
a.一直减小 b.始终不变 c.一直增大 d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO- + H2O + 2e- = Cl- + 2OH-,关于该电池的叙述正确的是
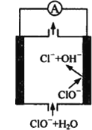
A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + ClO- + H2O = Mg(OH)2↓+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中某些元素的相关化合物在化工、医药、材料等领域有着广泛应用
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。Ga的外围电子排布式为:_____________________,基态Ga原子核外有______种运动状态不同的电子。
(2)锗、砷、硒、溴的第一电离能由大到小的顺序为____________(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维掺杂剂,其熔点为-49.5℃,沸点为83.1℃,则其晶体类型为_________,中心原子的杂化类型为________;砷酸的酸性弱于硒酸,从分子结构的角度解释原因_______________________。
(3)铁能形成[Fe(Bipy)2C12]ClO4等多种配合物(Bipy结构如下图A)。

①该配合物中中心原子的化合价为________;与中心原子形成配位键的原子是________。
②与ClO4-互为等电子体的一种非极性分子是_______(举1例)。
③1 mol Bipy中所含σ键______mol。
(4)钛(Ti)被誉为“21世纪金属”,Ti晶体的堆积方式是六方最密堆积如图B所示,晶胞可用图C表示。设金属Ti的原子半径为a cm,空间利用率为__________。设晶胞中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),则B点原子的坐标为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com