
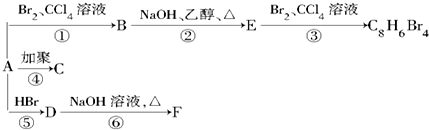
 ,D
,D ,E
,E ,
, +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O. 分析 1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O,各物质的物质的量之比等于其分子数之比,再结合原子守恒知,A分子中含有8个C原子、8个H原子,其分子式为C8H8,A中不饱和度=$\frac{8×2+2-8}{2}$=5,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,故A为 ,C为
,C为 ,A与溴发生加成反应生成B,则B为
,A与溴发生加成反应生成B,则B为 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为 ,E与溴发生加成反应生成
,E与溴发生加成反应生成 ,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故
,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故 与HBr放出加成反应生成D,则D为
与HBr放出加成反应生成D,则D为 ,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为
,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为 ,F与乙酸发生酯化反应生成H,故H为
,F与乙酸发生酯化反应生成H,故H为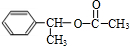 ,据此解答.
,据此解答.
解答 解:1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O,各物质的物质的量之比等于其分子数之比,再结合原子守恒知,A分子中含有8个C原子、8个H原子,其分子式为C8H8,A中不饱和度=$\frac{8×2+2-8}{2}$=5,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,故A为 ,C为
,C为 ,A与溴发生加成反应生成B,则B为
,A与溴发生加成反应生成B,则B为 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为 ,E与溴发生加成反应生成
,E与溴发生加成反应生成 ,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故
,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故 与HBr放出加成反应生成D,则D为
与HBr放出加成反应生成D,则D为 ,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为
,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为 ,F与乙酸发生酯化反应生成H,故H为
,F与乙酸发生酯化反应生成H,故H为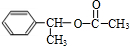 ,
,
(1)通过以上分析知,A的化学式为C8H8,
故答案为:C8H8;
(2)通过以上分析知,①是加成反应,②是消去反应,③是加成反应,④是加聚反应,⑤是加成反应,⑥是取代反应,
故答案为:②;
(3)由上述分析可知,C为 ,D为
,D为 ,E为
,E为 ,
,
故答案为: ;
; ;
; ;
;
(4)B→E是 在氢氧化钠醇溶液、加热条件下发生消去反应生成
在氢氧化钠醇溶液、加热条件下发生消去反应生成 ,反应方程式为:
,反应方程式为: +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O,
+2NaBr+2H2O,
故答案为: +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.
点评 本题考查有机物推断,涉及烃、卤代烃、烯烃、醇、酯之间的转化,正确推断A结构是解本题关键,会根据其不饱和度进行推断结构,注意物质之间转化条件,条件不同导致产物不同.


科目:高中化学 来源: 题型:选择题

| A. | M分子式为C6H6O7 | |
| B. | 1 mol物质M可以和3 mol氢气发生加成 | |
| C. | M分子不可以发生消除反应 | |
| D. | 足量的M分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 和若干个-CH3,则该烷烃的一氯代物有( )种.
和若干个-CH3,则该烷烃的一氯代物有( )种.| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.
火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ•mol-1 | 890.3 | 1299.6 | 285.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| C. | 等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| B. | X能与某些金属元素形成化合物 | |
| C. | X能形成化学式为X(OH)3的碱 | |
| D. | X可能形成化学式为KXO3的盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
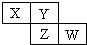 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的非金属性比Y的强 | |
| B. | Y的原子半径比Z的原子半径大 | |
| C. | Z的最高价氧化物的水化物为强酸 | |
| D. | W的单质可与Y的氢化物生成两种强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com