
【题目】在含有大量的Na+、OH﹣、NO3﹣ , 该溶液中还可能大量存在的离子是( )
A.NH4+
B.H+
C.SO42﹣
D.Mg2+
科目:高中化学 来源: 题型:
【题目】材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活.
(1)居室装修所用的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该物质是 ;
(2)玻璃是重要的硅酸盐产品.生产玻璃时,石灰石与石英反应的化学方程式 ;
(3)铁是人们生活中常见的金属材料,请列举两种防止铁制品被腐蚀的方法 、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 石灰石和盐酸反应 2H + + CO32- = CO2↑+ H2O
B. 过量的二氧化碳气体通入碳酸钠溶液 CO2 + CO32-+ H2O = 2HCO3-
C. 小苏打溶液中加入烧碱溶液 HCO3-+ OH - = CO2↑+ H2O
D. 小苏打溶液中加入醋酸 HCO3-+ H + = CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、CO(g)、CH3OH(l)的燃烧热![]() H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
A.甲醇不完全燃烧生成CO和液态水的热化学方程式:
CH3OH(l)+O2 (g)= CO(g)+2H2O(l) △H1=-1009.5kJ·mol-1
B.CH3OH(l)+1/2O2 (g)= CO2(g)+2H2 (g) △H1=-440.7kJ·mol-1
C.2H2O(g) = 2H2(g)+O2(g) △H1 =+571.6 kJ·mol-1
D.已知:S(s)+O2(g) = SO2(g) △H1 ;S(g)+O2(g) = SO2(g) △H2 ;则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2===CH2
CH2===CH2
CH2===CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
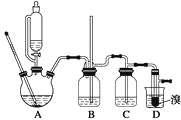
有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是_________________;
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”或“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用__________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是___________;但又不能过度冷却(如用冰水),其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对反应现象的描述错误的是
A. 铝热反应发生时,火星四射并发出大量的热
B. 将铜丝伸入浓硝酸中,产生红棕色气体
C. 将二氧化硫通入品红溶液中,溶液褪色
D. 氢气在氯气中燃烧,产生淡蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上制取硝酸的主要流程图如下图1:

(1)工业合成氨的原料是N2和H2。装置A的名称是 ;其中N2可从空气中分离出来,方法是先将空气 ,然后 即可得到;H2可以水和天然气为原料在催化剂作用下高温制取,其化学方程式为 。
(2)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)来实现。已知1100 K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O)∶c(CO)不低于 。
CO2(g)+H2(g)来实现。已知1100 K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O)∶c(CO)不低于 。
Ⅱ.利用石灰乳来除去硝酸工业的尾气(含NO、NO2),既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如上图2。已知NO和NO2按1:1通入碱液中生成亚硝酸盐。
(1)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是 ;滤渣可循环使用,滤渣的主要成分是 (填化学式)。
(2)该工艺需控制NO 和NO2 物质的量之比接近1:1。若n(NO):n(NO2)>1:1,则会导致 ;若n(NO):n(NO2)<1:1,则会导致 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com