
下列说法中正确的是
A.二氧化锰是催化剂,能加快反应速率
B.温度越高,催化剂的催化效果越好
C.食品包装袋中的抗氧化剂实质就是“负催化剂”,能使氧化还原反应的反应速率减小
D.升高温度,吸热反应和放热反应的反应速率都加快
科目:高中化学 来源: 题型:
若用图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是

| 选项 | 电源X极 | 实验前U形管中液体 | 混合溶液通电后现象或结论 |
| A | 正极 | Na2SO4 | 溶液U形管两端滴入酚酞后,a管中呈红色 |
| B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-===2H2O+O2↑ |
| C | 负极 | KCl和CuCl2 | 相同条件下,a、b两管中产生的气体总体积可能相等 |
| D | 负极 | Fe(OH)3 | b管中液体颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
可降解聚合物P的合成路线如下:
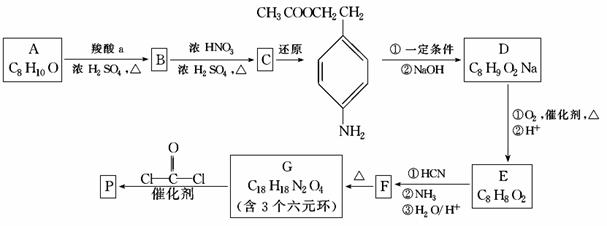
已知:

(1)A的含氧官能团名称是________。
(2)羧酸a的电离方程式是____________________________________。
(3)B→C的化学方程式是____________________________________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是____________________________________。
(5)E→F中反应①和②的反应类型分别是____________________________________。
(6)F的结构简式是____________________________________。
(7)聚合物P的结构简式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则:

①试写出a、b、c分别代表的意义:
a ;
b ;
c 。
②该反应是 反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 , 。(请写两条)
(3)已知:H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)==H2(l) ΔH=-0.92 kJ·mol-1
O2(g)==O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中加入0.6 mol A、 0.2 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[其中t0~t1阶段c(B)未画出]。t2时刻后改变条件反应体系中反应速率随时间变化的情况如乙图所示,且四个阶段都各改变一种条件并且改变的条件均不相同。下列说法正确的是
0.2 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[其中t0~t1阶段c(B)未画出]。t2时刻后改变条件反应体系中反应速率随时间变化的情况如乙图所示,且四个阶段都各改变一种条件并且改变的条件均不相同。下列说法正确的是
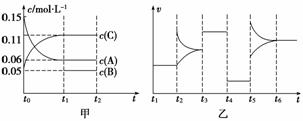
A.反应的方程式为3A(g)+B(g)  2C(g)
2C(g)
B.t3~t4,t4~t5,t5~t6各阶段可能改变的条件依次为:加催化剂,降低反应温度,增大压强
C.B的起始物质的量为0.08 mol
D.若t1=10 s,A在t0~t1时间段的反应速率为0.002 25 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50 mol·L-1
D.B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO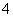 +H2C2O4+H+——Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol·L-1KMnO4溶液与2 mL 0.01 mol·L-1H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
+H2C2O4+H+——Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol·L-1KMnO4溶液与2 mL 0.01 mol·L-1H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________________________________________________________________________。
(2)如果研究催化剂对化学反应速率的影响,使用实验______和______(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验______和______。
(3)对比实 验Ⅰ和Ⅳ,
验Ⅰ和Ⅳ, 可以研究________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是__________________________________________
可以研究________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是__________________________________________ ________________________。
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中镁的总储量约为2.1×1015 t,目前世界上60%的镁来自海水。工业上从海水中提取镁的步骤为:
①将海水中大量存在的贝壳煅烧成石灰;②将石灰制成石灰乳;③将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;④在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到Mg Cl2·6H2O;⑤将MgCl2·6H2O在一定条件下加热得到无水MgCl2;⑥电解熔融的MgCl2可得到镁。
Cl2·6H2O;⑤将MgCl2·6H2O在一定条件下加热得到无水MgCl2;⑥电解熔融的MgCl2可得到镁。
试回答下列问题:
(1)请写出海水提取镁的过程中①、⑥反应的化学方程式:
①____________________;⑥____________________。
(2)工业上采用电解MgCl2的方法制得金属镁,电解槽中阴极的电极反应式为:________________________________________________________________________。
(3)步骤⑤中的“一定条件”指的是_______,目的是_____________________。
(4)上述提取镁的流程中,可以在降低成本,减少污染方面做出一些工作,请写出其中一点______________________________________。
(5)有同学认为上述过程中,可加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学 的想法吗?为什么?_____________________________
的想法吗?为什么?_____________________________ ___________________________________________
___________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2C2O4 H2O+CO↑+CO2↑ 实验室可以用下图所示装置,设计一个实验,用草酸固体分解,证明该反应生成物中有CO和CO2。回答下列问题:

(1)浓硫酸的作用为 ,应放在 中(填仪器名称)
(2)装置的正确连接顺序为(填接口的代码字母)
(3)能说明生成物中有CO的现象是
(4)能证明生成物中有CO2的现象是
(5) 该套实验装置有什么缺陷,如何改进?
(6) 写出H2C2O4与乙二醇反应的方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com