
向某密闭容器中加入0.6 mol A、 0.2 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[其中t0~t1阶段c(B)未画出]。t2时刻后改变条件反应体系中反应速率随时间变化的情况如乙图所示,且四个阶段都各改变一种条件并且改变的条件均不相同。下列说法正确的是
0.2 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[其中t0~t1阶段c(B)未画出]。t2时刻后改变条件反应体系中反应速率随时间变化的情况如乙图所示,且四个阶段都各改变一种条件并且改变的条件均不相同。下列说法正确的是
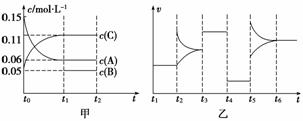
A.反应的方程式为3A(g)+B(g)  2C(g)
2C(g)
B.t3~t4,t4~t5,t5~t6各阶段可能改变的条件依次为:加催化剂,降低反应温度,增大压强
C.B的起始物质的量为0.08 mol
D.若t1=10 s,A在t0~t1时间段的反应速率为0.002 25 mol·L-1·s-1
科目:高中化学 来源: 题型:
某酯A,其分子式C6H12O2,已知

又知B、C、D、E均为有机物,D不与Na2CO3溶液反应,E不能发生银镜反应,则A结构可能有
A.5种 B.4种
C.3种 D.2种
查看答案和解析>>
科目:高中化学 来源: 题型:
强酸与强碱的稀溶液发生中和反应的热效应为: H+(aq)+OH-(aq)===H2O(l) ΔH =-57.3kJ·mol-1。分别向1 L 0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,下列关系正确的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3 C.ΔH1=ΔH2<ΔH3 D.ΔH1<ΔH2=ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
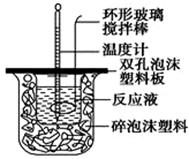
(1)烧杯间填满碎泡沫塑料的作用是___________________________
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),
其原因是_______________________________________________________。
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是______________________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量_______ _____(填“相等”“不相等”),若实验操作均正确,则所求中和热________________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.二氧化锰是催化剂,能加快反应速率
B.温度越高,催化剂的催化效果越好
C.食品包装袋中的抗氧化剂实质就是“负催化剂”,能使氧化还原反应的反应速率减小
D.升高温度,吸热反应和放热反应的反应速率都加快
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
A.反应前5秒钟内,用NO表示的平均反应速率为0.1 mol·L-1·s-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝热法冶炼难熔的金属,其优越性在于( )
A铝有很强还原性,高温下可将难熔金属从其氧化物中还原出来
B.氧化铝熔点低,容易与难熔金属分离
C.反应放出大量热量,使还原出来的金属熔化,便于分离
D.氧化铝熔点高,容易与难熔金属一起熔化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com