
用铝热法冶炼难熔的金属,其优越性在于( )
A铝有很强还原性,高温下可将难熔金属从其氧化物中还原出来
B.氧化铝熔点低,容易与难熔金属分离
C.反应放出大量热量,使还原出来的金属熔化,便于分离
D.氧化铝熔点高,容易与难熔金属一起熔化
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素 A1。
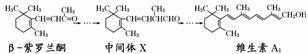
下列说法正确的是( )
A.β-紫罗兰酮可使酸性 KMnO4 溶液褪色
B.1 mol中间体 X最多能与3 mol H2发生加成反应
C.维生素 A1 易溶于NaOH 溶液
D.β-紫罗兰酮与中间体X互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中加入0.6 mol A、 0.2 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[其中t0~t1阶段c(B)未画出]。t2时刻后改变条件反应体系中反应速率随时间变化的情况如乙图所示,且四个阶段都各改变一种条件并且改变的条件均不相同。下列说法正确的是
0.2 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[其中t0~t1阶段c(B)未画出]。t2时刻后改变条件反应体系中反应速率随时间变化的情况如乙图所示,且四个阶段都各改变一种条件并且改变的条件均不相同。下列说法正确的是
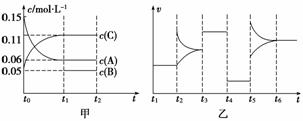
A.反应的方程式为3A(g)+B(g)  2C(g)
2C(g)
B.t3~t4,t4~t5,t5~t6各阶段可能改变的条件依次为:加催化剂,降低反应温度,增大压强
C.B的起始物质的量为0.08 mol
D.若t1=10 s,A在t0~t1时间段的反应速率为0.002 25 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO +H2C2O4+H+——Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol·L-1KMnO4溶液与2 mL 0.01 mol·L-1H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
+H2C2O4+H+——Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol·L-1KMnO4溶液与2 mL 0.01 mol·L-1H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________________________________________________________________________。
(2)如果研究催化剂对化学反应速率的影响,使用实验______和______(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验______和______。
(3)对比实 验Ⅰ和Ⅳ,
验Ⅰ和Ⅳ, 可以研究________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是__________________________________________
可以研究________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是__________________________________________ ________________________。
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下金属的冶炼方法在工业上不适用的是( )
A.Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
B.Al2O3+3CO 2Al+3CO2
2Al+3CO2
C.MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
D.2HgO 2Hg+O2↑
2Hg+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中镁的总储量约为2.1×1015 t,目前世界上60%的镁来自海水。工业上从海水中提取镁的步骤为:
①将海水中大量存在的贝壳煅烧成石灰;②将石灰制成石灰乳;③将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;④在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到Mg Cl2·6H2O;⑤将MgCl2·6H2O在一定条件下加热得到无水MgCl2;⑥电解熔融的MgCl2可得到镁。
Cl2·6H2O;⑤将MgCl2·6H2O在一定条件下加热得到无水MgCl2;⑥电解熔融的MgCl2可得到镁。
试回答下列问题:
(1)请写出海水提取镁的过程中①、⑥反应的化学方程式:
①____________________;⑥____________________。
(2)工业上采用电解MgCl2的方法制得金属镁,电解槽中阴极的电极反应式为:________________________________________________________________________。
(3)步骤⑤中的“一定条件”指的是_______,目的是_____________________。
(4)上述提取镁的流程中,可以在降低成本,减少污染方面做出一些工作,请写出其中一点______________________________________。
(5)有同学认为上述过程中,可加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学 的想法吗?为什么?_____________________________
的想法吗?为什么?_____________________________ ___________________________________________
___________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.为了消除碘缺乏病,在食盐中必须加入一定量的单质碘
B.新制氯水中含有的分子包括Cl2、H2O,含有的离子包括H+、Cl-、ClO-
C.新能源汽车的推广与使用有助于减少光化学烟雾的产生
D.PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铵是一种常用的化肥,其工业生产流程如下图,请回答下列问题。
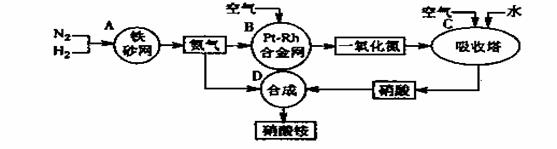
⑴写出反应容器B中发生反应的化学方程式: 。
⑵吸收塔C中通入空气的目的是 ;
A、B、C、D四个反应容器中发生的反应,属于氧化还原反应的是 (填反应容器代号)。
⑶浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因: 。
⑷金属铜与浓硝酸反应的离子方程式是 ,该反应中浓硝酸表现的性质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol· L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com