
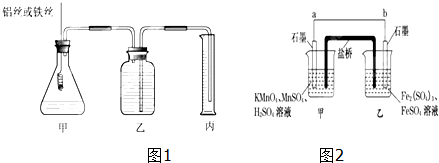
分析 (1)根据金属和酸反应的快慢判断金属性强弱;
(2)根据v=$\frac{△V}{△t}$分析;
(3)影响化学反应速率的因素有温度、压强、浓度、催化剂、表面积等,据此分析;
(4)由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.
解答 解:(1)根据金属和酸反应置换氢的难易判断金属性强弱,故甲中应为稀盐酸或稀硫酸,
故答案为:稀硫酸或稀盐酸;
(2)由v=$\frac{△V}{△t}$可知,反应速率与气体的体积和时间有关,所以一种是固定体积比较时间,另一种是固定时间比较体积,
故答案为:产生相同体积的气体所需时间的长短;
(3)影响化学反应速率的因素有反应物的浓度、溶液的温度、固体的表面积等,所以还需保证Al和Fe表面积相同,
故答案为:Al和Fe表面积相同;
(4)由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,
(i)b为负极,则乙烧杯中发生氧化反应,
故答案为:乙;
(ii)由上述分析可知,a为正极,电流由正极流向负极,即从a流向b,
故答案为:a;b;
(iii)阴离子向负极移动,则盐桥中的SO42-移向乙烧杯中,
故答案为:乙;
(iv)甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO4-+8H++5e-═Mn2++4H2O,
故答案为:MnO4-+8H++5e-═Mn2++4H2O.
点评 本题考查了测气体的反应速率的方法,理解所学知识要点,通过比较、分析是解答的关键,注意外界条件影响化学反应速率,但决定化学反应速率的是物质本身的性质,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠形成的晶体中,每个钠原子周围与其距离最近的原子有8个 | |
| B. | 金属镁形成的晶体中,每个镁原子周围与其距离最近的原子有6个 | |
| C. | 在NaCl晶体中,每个Na+周围与其距离最近的Na+有12个 | |
| D. | 在CsCl晶体中,每个Cs+周围与其距离最近的Cl-有8个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
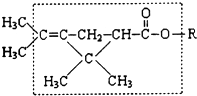 大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )| A. | 能发生加氢反应,但其生成物无杀虫作用 | |
| B. | 在酸性溶液中,此类杀虫剂将会失去杀虫作用 | |
| C. | 此类杀虫剂密封保存在碱溶液中,会丧失其杀虫作用 | |
| D. | 左端的甲基(-CH3)不可被替换为H,否则其替代物将失去杀虫作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.某实验兴趣小组做完实验后,在读书卡上的记录如下所示,则卡片上的描述合理的是( )
如图把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.某实验兴趣小组做完实验后,在读书卡上的记录如下所示,则卡片上的描述合理的是( )| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 用惰性电极电解饱和MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+Cl2↑ | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:CO>N2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 还原性:HF>HCl>HBr>HI | D. | 沸点:HF>H2O>NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com