
【题目】铬(Cr)硬度大抗腐蚀性和耐磨性好,具有广泛的应用前景一种以铬铁矿(含FeCr2O4及少量Al2O3SiO2等)为原料制备金属铬的工艺流程如下:
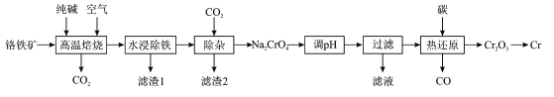
回答下列问题:
(1)“高温焙烧”中主要反应的化学方程式为____
(2)为提高“水浸”的浸取率,除了适当升高温度,还可采取的措施是____
(3)“滤渣1”是一种红棕色固体,为检验其中的金属元素,可选择的常用试剂是____“滤渣2”的主要成分是__________
(4)“调pH”的目的是____
(5)“热还原”主要是利用焦炭与重铬酸盐得到Cr2O3和另一种固体产物,该固体产物可返回__________工序循环使用
(6)可用铝热法还原Cr2O3制备铬单质,铝热反应中镁带的作用是____;还可用惰性电极电解硫酸铬钾[KCr(SO4)2]溶液制备,阴极的电极反应式为____
【答案】4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+CO2, 适当延长浸取时间或搅拌 盐酸(或稀硫酸)、KSCN溶液 H2SiO3和Al(OH)3 增大H+浓度,使平衡2
2Fe2O3+8Na2CrO4+CO2, 适当延长浸取时间或搅拌 盐酸(或稀硫酸)、KSCN溶液 H2SiO3和Al(OH)3 增大H+浓度,使平衡2![]() +2H+
+2H+![]() 2
2![]() +H2O方向移动,将Na2CO4转化为Na2Cr2O7 高温熔烧 引燃剂(或利用镁条燃烧放出的热量引发铝热反应) Cr3++3e-= Cr
+H2O方向移动,将Na2CO4转化为Na2Cr2O7 高温熔烧 引燃剂(或利用镁条燃烧放出的热量引发铝热反应) Cr3++3e-= Cr
【解析】
根据流程:铬铁矿[主要成分为Fe(CrO2)2,还含有Fe2O3、A12O3、SiO2等杂质]在空气中与纯碱高温煅烧,发生反应:Al2O3+Na2CO3![]() 2NaAlO2+CO2↑、SiO2+Na2CO3
2NaAlO2+CO2↑、SiO2+Na2CO3![]() Na2SiO3+CO2↑、4Fe(CrO2)2+7O2+8Na2CO3
Na2SiO3+CO2↑、4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+CO2,得到含有NaA1O2、Na2SiO3、Na2CrO4、Fe2O3的固体产物,水浸,Fe2O3不溶,滤渣I为Fe2O3,滤液I含有NaA1O2、Na2SiO3、Na2CrO4,通入二氧化碳调节pH值使NaA1O2、Na2SiO3转化为Al(OH)3和H2SiO3,发生反应:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,则滤渣2为Al(OH)3和H2SiO3,滤液主要含有CrO42-,再次调节pH发生反应:2CrO42-+2H+Cr2O72-+H2O,将CrO42-转化为Cr2O72-,用碳作还原剂,热还原法将Na2Cr2O7转化为Cr2O3同时生成碳酸钠和CO,发生反应:Na2Cr2O7+2C
2Fe2O3+8Na2CrO4+CO2,得到含有NaA1O2、Na2SiO3、Na2CrO4、Fe2O3的固体产物,水浸,Fe2O3不溶,滤渣I为Fe2O3,滤液I含有NaA1O2、Na2SiO3、Na2CrO4,通入二氧化碳调节pH值使NaA1O2、Na2SiO3转化为Al(OH)3和H2SiO3,发生反应:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,则滤渣2为Al(OH)3和H2SiO3,滤液主要含有CrO42-,再次调节pH发生反应:2CrO42-+2H+Cr2O72-+H2O,将CrO42-转化为Cr2O72-,用碳作还原剂,热还原法将Na2Cr2O7转化为Cr2O3同时生成碳酸钠和CO,发生反应:Na2Cr2O7+2C![]() Na2CO3+ Cr2O3+CO↑;利用铝热法还原Cr2O3制取金属铬,据此分析解答。
Na2CO3+ Cr2O3+CO↑;利用铝热法还原Cr2O3制取金属铬,据此分析解答。
(1)“高温焙烧”中主要反应的化学方程式为4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+CO2;
2Fe2O3+8Na2CrO4+CO2;
(2)为提高“水浸”的浸取率,除了适当升高温度,还可采取的措施是适当延长浸取时间或搅拌;
(3)根据分析,滤渣I为Fe2O3,为检验其中的金属元素,先用盐酸(或稀硫酸)溶解转化为Fe3+,再加入KSCN溶液,若溶液变为血红色,则证明含有铁元素;“滤渣2”的主要成分是Al(OH)3和H2SiO3;
(4)调节pH的目的是增大溶液中H+的浓度,使反应2CrO42-+2H+Cr2O72-+H2O平衡正向移动,使Na2CrO4转化为Na2Cr2O7;
(5)“热还原”主要是利用焦炭与重铬酸盐得到Cr2O3和另一种固体产物,发生反应:Na2Cr2O7+2C![]() Na2CO3+ Cr2O3+CO↑,该Na2CO3固体产物可返回高温熔烧工序循环使用;
Na2CO3+ Cr2O3+CO↑,该Na2CO3固体产物可返回高温熔烧工序循环使用;
(6)可用铝热法还原Cr2O3制备铬单质,铝热反应中镁带的作用是作引燃剂,利用镁条燃烧放出的热量引发铝热反应;还可用惰性电极电解硫酸铬钾[KCr(SO4)2]溶液制备,阴极上电解质溶液中的阳离子放电,根据放电顺序,Cr3+在阴极放电,电极反应式为Cr3++3e-= Cr。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将几滴KSCN(SCN-是“类似卤离子”)溶液加入到酸性的含有Fe3+的溶液中,溶液变为红色,将该红色溶液分为两份:①向其中—份溶液中加入适量KMnO4溶液,红色褪去;②向另一份溶液中通入SO2,红色也褪去。下列说法中不正确的是
A. ①中红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失
B. ②中红色褪色的原因是SO2将Fe3+还原为Fe2+
C. ②中红色裡色的原因是SO2将SCN-还原
D. SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图I碱性锌锰电池 | 图II铅-硫酸蓄电池 | 图III电解精炼铜 | 图IV银锌纽扣电池 |
A.图Ⅰ所示电池中,正极的电极反应式为Zn-2e+2OH-=Zn(OH)2
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池工作过程中,电子由Zn极沿导线流向Ag2O极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的绿色能源,![]() 是一种温室气体,都是重要的化工原料。
是一种温室气体,都是重要的化工原料。
(1)已知CO(g)+2H2(g)![]() CH3OH(1);ΔH=-129kJ·mol1,该反应的ΔS_________(填“>”或“<”)0。
CH3OH(1);ΔH=-129kJ·mol1,该反应的ΔS_________(填“>”或“<”)0。
(2)向温度不同容积均为1L的a、b、c、d、e五个恒容密闭容器中各充入3molCO2、7molH2的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=QkJ·mol1,反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数(H2O)如图所示。
CH3OH(g)+H2O(g)ΔH=QkJ·mol1,反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数(H2O)如图所示。

①Q_______(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是_________。
②t1时刻时,容器a中正反应速率________(填“大于”“小于”或“等于”)容器e中正反应速率;
③Td℃时,该反应的平衡常数K=__________;
④欲提高H2的转化率,可采取的措施有______________________,(写出两种);
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品.
①请写出CO2的电子式_______________________________。
②NaOH溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(NaHCO3)∶c(Na2CO3)=1∶1,则所得溶液的离子浓度的大小关系是____________。
③在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,将微溶的CaSO4难溶性的CaCO3的理由是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双一(对烷氧基苯甲酸)-2,3一二氯—1,4—苯二酚酯(G)是一种新的液晶化合物,在液晶显示领域里有广泛的应用,其合成路线如下:

已知:R为烷烃基,D的核磁共振氢谱为四组峰,且峰面积之比为9:2:2:1。
回答下列问题:
(1)A的结构简式为______________________________。
(2)B的化学名称为_________________________。
(3)A与B生成C的化学方程式为_____________________________。
(4)由E生成G的反应类型为______________________。
(5)G的分子式为______________________。
(6)H是D的同分异构体,H的苯环上只有两个对位的取代基,H可与FeCl3溶液发生显色反应,且能发生水解反应和银镜反应,则H共有______种;其中核磁共振氢谱为六组峰,且峰面积之比为1:2:6:2:2:1的结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,一定体积的的密闭容器中有如下平衡:H2(g)+I2(g)![]() 2HI(g)。已知H2和I2的起始浓度均为0.10mol·L-1,达到平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是( )
2HI(g)。已知H2和I2的起始浓度均为0.10mol·L-1,达到平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是( )
A.0.16B.0.08C.0.04D.0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。
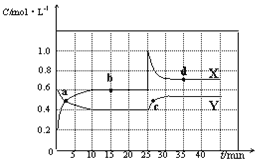
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是___;a、b、c、d四个点中,表示化学反应处于平衡状态的点是___。
(2)前10min内用NO2表示的化学反应速率v(NO2)=___mol·L-1·min-1。
(3)①据图分析,在25min时采取的措施是___(填序号)。
A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35 min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com