
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图I碱性锌锰电池 | 图II铅-硫酸蓄电池 | 图III电解精炼铜 | 图IV银锌纽扣电池 |
A.图Ⅰ所示电池中,正极的电极反应式为Zn-2e+2OH-=Zn(OH)2
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池工作过程中,电子由Zn极沿导线流向Ag2O极
【答案】D
【解析】
A.碱性锌锰电池中,Zn元素化合价升高,被氧化,Mn元素化合价降低,被还原,则锌作负极、二氧化锰作正极,正极得电子发生还原反应,电极反应为MnO2+H2O+e-=MnOOH+OH-,故A错误;
B.铅蓄电池放电时电池反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,放电过程中硫酸不断被消耗,浓度降低,故B错误;
C.粗铜中不仅含有铜还含有其它金属,电解时,粗铜中有铜和其它比铜活泼的金属均可被氧化而溶解,纯铜上只有铜离子得电子,所以阴极上析出的铜大于阳极上减少的铜,所以溶液中铜离子浓度降低,故C错误;
D.该电池工作时Zn被氧化作负极,Ag2O被还原作正极,原电池中电子由负极经导线流向正极,故D正确;
故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】浓硫酸和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C![]() CO2↑+2H2O+2SO2↑。用如图所示装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。
CO2↑+2H2O+2SO2↑。用如图所示装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。
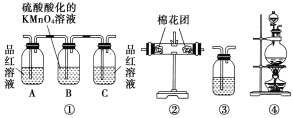
(1)这些装置的连接顺序(按产物气流从左到右的方向)是____→___→____→____。(填装置的序号)
(2)装置②中要检验产物中有水蒸气,则放入的药品是______;装置③中要检验产物中有二氧化碳气体,则放入的药品是___________;实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是_______,B瓶溶液的作用是_________,C瓶溶液的作用是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在大试管内将足量NaHCO3加热到 200℃,将产生的混合气体通入到盛有1.87 g Na2O和Na2O2的密闭容器中,待Na2O和Na2O2全部反应后,得到标准状况下224 mL O2;再将反应后密闭容器内的固体全部溶于水配成 100 mL 溶液。下列说法正确的是
A.Na2O和Na2O2 均为碱性氧化物
B.参加反应的NaHCO3物质的量为 0.04 mol
C.反应过程中总共转移 0.04 mol 电子
D.配成的 100 mL 溶液中 c(Na+) = 0.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为CO2与CH4转化为CH3COOH的反应历程(中间体的能量关系如虚框中曲线所示),图2为室温下某溶液中CH3COOH和CH3COO-两种微粒浓度随pH变化的曲线。下列结论错误的是

A. CH4分子在催化剂表面会断开C—H键,断键会吸收能量
B. 中间体①的能量大于中间体②的能量
C. 室温下,CH3COOH的电离常数Ka=10-4.76
D. 升高温度,图2中两条曲线交点会向pH增大方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬(Cr)硬度大抗腐蚀性和耐磨性好,具有广泛的应用前景一种以铬铁矿(含FeCr2O4及少量Al2O3SiO2等)为原料制备金属铬的工艺流程如下:
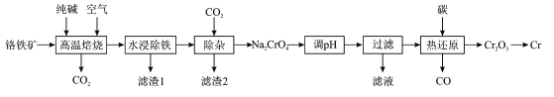
回答下列问题:
(1)“高温焙烧”中主要反应的化学方程式为____
(2)为提高“水浸”的浸取率,除了适当升高温度,还可采取的措施是____
(3)“滤渣1”是一种红棕色固体,为检验其中的金属元素,可选择的常用试剂是____“滤渣2”的主要成分是__________
(4)“调pH”的目的是____
(5)“热还原”主要是利用焦炭与重铬酸盐得到Cr2O3和另一种固体产物,该固体产物可返回__________工序循环使用
(6)可用铝热法还原Cr2O3制备铬单质,铝热反应中镁带的作用是____;还可用惰性电极电解硫酸铬钾[KCr(SO4)2]溶液制备,阴极的电极反应式为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是N2与H2反应的能量变化曲线图。下列叙述正确的是
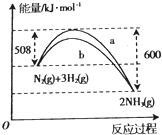
A. 该反应的热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g),△H = +92 kJ/mol
2NH3(g),△H = +92 kJ/mol
B. b曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热减小
D. 加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com