
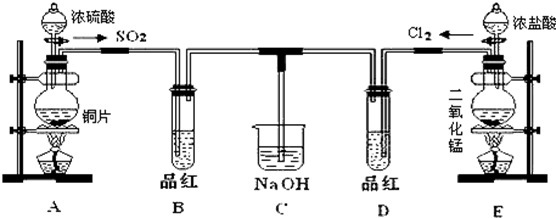

分析 (1)根据装置图可知,A中是铜与浓硫酸反应生成二氧化硫、硫酸铜和水,在该反应中浓硫酸生成硫酸铜体现酸性,生成二氧化硫体现氧化性;
(2)实验室用装置E中二氧化锰与浓盐酸加热制备Cl2,同时生成氯化锰和水,根据化合价的变化可知,该反应中氯化氢中的氯从-1价变为0价;
(3)①根据装置图可知,装置A和E中,常用于萃取操作的仪器是分液漏斗;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,加热也不能恢复红色;
(4)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl;
(5)①Br2氧化SO2放出很多热量,液溴、氢溴酸易挥发,反应室①使用冰水降低温度;
②操作I是将互溶的硫酸、氢溴酸分离,而氢溴酸易挥发,应采取蒸馏进行分离;操作Ⅱ分离固体与液体;
③粗品中可能含有挥发出的Br2,加入Na2SO3,与粗品中的Br2反应;
④A.用KSCN溶液检验Fe3+,溶液变成血红色;
B.由工艺流程可知,溶液中可能溶解了少量Br2,可以用CCl4萃取方法检验.
解答 解:(1)根据装置图可知,A中是铜与浓硫酸反应生成二氧化硫、硫酸铜和水,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O,在该反应中浓硫酸既有氧化性又有酸性,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;既有氧化性又有酸;
(2)实验室用装置E中二氧化锰与浓盐酸加热制备Cl2,同时生成氯化锰和水,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,根据化合价的变化可知,该反应中氯化氢中的氯从-1价变为0价,所以该反应中的还原剂是HCl,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;HCl;
(3)①根据装置图可知,装置A和E中,常用于萃取操作的仪器是分液漏斗,
故答案为:分液漏斗;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,加热也不能恢复红色,
故答案为:褪色的品红恢复红色;无明显现象;
(4)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,发生Cl2+SO2+2H2O=2HCl+H2SO4,不再具有漂白性,
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4;
(5)①Br2氧化SO2放出很多热量,液溴、氢溴酸易挥发,反应室①使用冰水降低温度,防止Br2和HBr挥发,
故答案为:防止Br2和HBr挥发;
②操作I是将互溶的硫酸、氢溴酸分离,而氢溴酸易挥发,应采取蒸馏进行分离;操作Ⅱ分离固体与液体,应是过滤,
故答案为:蒸馏;过滤;
③粗品中可能含有挥发出的Br2,加入Na2SO3,还原除去粗品中的Br2,
故答案为:还原除去粗品中的Br2;
④A.用KSCN溶液检验Fe3+:取少许溶液滴加KSCN溶液,溶液变成血红色,说明氢溴酸呈淡黄色是因为含Fe3+,
故答案为:KSCN溶液;溶液变成血红色;
B.由工艺流程可知,溶液中可能溶解了少量Br2,可以用CCl4萃取方法检验:加入CCl4进行萃取,若观察CCl4中有橙红色液体出现,则可证明,
故答案为:溶解了少量Br2;加入CCl4进行萃取,若观察CCl4中有橙红色液体出现,则可证明.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握物质的性质、气体的制备实验、性质实验及实验技能等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
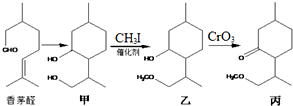
| A. | 香茅醛能发生加聚反应和缩聚反应 | |
| B. | “甲→乙”发生了取代反应 | |
| C. | 甲中不同化学环境的羟基化学性质不同 | |
| D. | 香茅醛存在顺反异构现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol C12通入足量NaOH溶液中,转移电子数为NA | |
| B. | 18g D2O含有的中子数为10NA | |
| C. | 0.1mol/L的Na2CO3溶液含CO32-数目为0.1NA | |
| D. | 已知白磷(P4)分子结构为正四面体,则1mol P4含共价键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面粉生产车间应严禁烟火 | |
| B. | 含Cl2的尾气用碱溶液处理后再排放 | |
| C. |  天然气运输时应悬挂图所示的标志 | |
| D. | 金属钠失火时应立即用大量冷水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
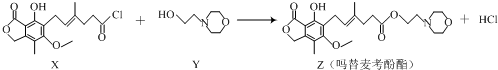
| A. | 化合物X中含有手性碳原子 | B. | 化合物Y的分子式为C6H12NO2 | ||
| C. | 1mol化合物Z可以与3mol NaOH反应 | D. | 用溴水可鉴别化合物X和Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释 |
| A | 向AlCl3溶液中逐滴加入NaOH溶液并振荡 | 产生白色沉淀,后沉淀逐渐溶解 | 铝元素具有一定的非金属性 |
| B | 将Fe(NO3)2固体溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | 稀硫酸将Fe2+氧化为Fe3+ |
| C | 向KBrO3溶液中加入少量CCl4,然后通入少量Cl2,充分振荡,静置 | 下层呈橙色 | 氧化性:Cl2>Br2 |
| D | 将充有NO2的玻璃球放入热水中 | 红棕色加深 | 2NO2?N2O4△H>0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 饱和硫酸铵和醋酸铅溶液均能使鸡蛋清溶液发生变性 | |
| C. | 油脂、二肽发生水解反应均可能得到含羧基的物质 | |
| D. | 天然橡胶 和杜仲胶 和杜仲胶 的单体是同种物质 的单体是同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 | |
| 起始量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 0~5min内,甲中SO2的反应速率为0.032mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=400 | |
| C. | 平衡时,SO2的转化率:α1<80%<α2 | |
| D. | 平衡时,丙中气体平均相对分子质量与甲相同 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
某元素的一种同位素X 的质量数为A,含N个中子,它与1H 原子组成HmX分子,在ag HmX 中所含质子的物质的量是
A. 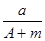 (A-N+m)mol B.
(A-N+m)mol B. 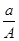 (A-N)mol
(A-N)mol
C. 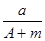 ( A-N)mol D.
( A-N)mol D. 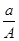 (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com