
【题目】下列说法正确的是
A. 甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:

已知:滤渣2中除了过量的MgO外,还含有Fe(OH)3。
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为__________。
(2)滤渣1的化学式为__________________。
(3)流程中“氧化”的氧化剂是:_________,写出该流程的离子方程式为______________。
(4)高温煅烧过程中,同时存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。

①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 生成乙烯的速率:v(N)一定大于v(M) B. 该反应的逆反应为吸热反应
C. 平衡常数:KM>KN D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. 原NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8moL/L
B. a点水的电离程度小于c点水的电离程度
C. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+(OH-)
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制240mL 1.2mol/L的NaOH溶液,填空请回答下列问题:
(1)配制240mL 1.2mol/L的NaOH溶液
应称取NaOH的质量/g | 选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
_________ | ________ | _______ |
(2)容量瓶上需标有以下五项中的_____________________;
①浓度 ② 温度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___;
A.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
B.用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G 装入贴好标签的试剂瓶待用
(4)下列配制的溶液浓度偏低的是__;
A.称量NaOH时,在滤纸上称量
B.配制前,容量瓶中有少量蒸馏水
C.加蒸馏水时不慎超过了刻度线
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E 容量瓶在使用前烘干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水的电离平衡曲线如右图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25 ℃)________KW(100 ℃)(填“>”、“<”或“=”)。

(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为____ ___。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯乙酸(ClCH2-COOH)在有机合成中是一种重要的原料和中间体,在硫单质催化下干燥氯气与乙酸反应制得一氯乙酸:![]()
![]()
![]()
已知:

请回答下列问题:
(1)选用下图的装置制备一氯乙酸粗品。

①按照气流从左至右依次连接的合理顺序为____→____→____→____→____→i→j→g→h(填接口字母)。____
②洗气瓶中的溶液为____,碱石灰的作用是____。
(2)制备一氯乙酸时,首先采用____(填“水浴”、“油浴”或“沙浴”)加热方法控制温度在95℃左右,待温度稳定后,再打开弹簧夹、____(填操作),如果三颈烧瓶溶液表面观察到大量 ___(填现象)时,应该___(填操作),以减少氯气通入量,以免浪费。
(3)一氯乙酸粗品中含有二氯乙酸、三氯乙酸,多次蒸馏后产品中仍含有少量的____(填物质名称),再进行____(填“过滤”、“分液”或“重结晶”),可得到纯净的一氯乙酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内最新研究,实现CO2的固定和储能的多功能电化学反应装置,如图所示。该装置充放电过程并不完全可逆,即充电过程C不参与反应。放电过程反应方程式为:4Li+3CO2=2Li2CO3+C,下列叙述正确的是
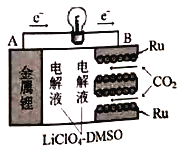
A. 放电过程正极反应式为4Li++3CO2+4e-=2Li2CO3+C
B. 若放电过程转移电子物质的量为0.2mol,理论上可以固定C的质量为1.2g
C. 充电过程B电极为阴极,发生氧化反应
D. 可用 LiClO4水溶液代替LiClO4-DMSO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用图9所示装置制备1,2二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:

(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式 ;该反应类型为 。
(2)写出制备1,2二溴乙烷的化学方程式 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(4)容器c中NaOH溶液的作用是 ;e装置内NaOH溶液的作用是 。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com