
【题目】一氯乙酸(ClCH2-COOH)在有机合成中是一种重要的原料和中间体,在硫单质催化下干燥氯气与乙酸反应制得一氯乙酸:![]()
![]()
![]()
已知:

请回答下列问题:
(1)选用下图的装置制备一氯乙酸粗品。

①按照气流从左至右依次连接的合理顺序为____→____→____→____→____→i→j→g→h(填接口字母)。____
②洗气瓶中的溶液为____,碱石灰的作用是____。
(2)制备一氯乙酸时,首先采用____(填“水浴”、“油浴”或“沙浴”)加热方法控制温度在95℃左右,待温度稳定后,再打开弹簧夹、____(填操作),如果三颈烧瓶溶液表面观察到大量 ___(填现象)时,应该___(填操作),以减少氯气通入量,以免浪费。
(3)一氯乙酸粗品中含有二氯乙酸、三氯乙酸,多次蒸馏后产品中仍含有少量的____(填物质名称),再进行____(填“过滤”、“分液”或“重结晶”),可得到纯净的一氯乙酸。
【答案】b→e→f→c→d 饱和食盐水 吸收多余的氯气和酸性污染气体 水浴 打开活塞放下浓盐酸并点燃酒精灯 黄绿色气体 控制活塞减慢浓盐酸滴加速率或控制酒精灯降低加热温度 二氯乙酸 重结晶
【解析】
(1)①制备一氯乙酸粗品先需要制备氯气,氯气含有HCl和H2O(g),需要除杂,除杂不能用碱石灰(因为碱石灰也吸收氯气),进入反应装置后,最后就是尾气处理;
②氯气含有HCl和H2O(g)杂质,无水氯化钙是除去水蒸气,那么洗气瓶为了除去氯气中HCl,碱石灰是放在最后处理尾气;
(2)水浴温度0-100℃,油浴温度100-260℃,沙浴温度400-600℃,氯气为黄绿色气体,通过颜色判断氯气的量;
(3)根据题中一氯乙酸、二氯乙酸、三氯乙酸的熔沸点数据,沸点相差越近越难蒸馏分来。
(1)①用MnO2制备Cl2需要加热,产生的Cl2含有杂质,先洗气除去HCl,再用无水CaCl2除去H2O(g),纯净的Cl2通入三颈烧瓶进行反应,最后多余的Cl2和反应生成的HCl用碱石灰吸收,所以连接顺序为b→e→f→c→d。答案:b→e→f→c→d;
②洗气瓶为了除去氯气中HCl,应用饱和食盐水除杂;碱石灰能吸收酸性气体,可以将氯气和产生的酸性气体(HCl)吸收。答案:饱和食盐水;吸收多余的氯气和酸性污染气体;
(2)水的沸点为100℃,要控制温度在95℃左右,可采用水浴加热方法;温度稳定后,打开弹簧夹,打开分液漏斗活塞滴加浓盐酸并点燃酒精灯制备氯气;如果三颈烧瓶溶液表面观察到大量黄绿色气体,说明氯气过量,此时应控制活塞减慢浓盐酸滴加速率或控制酒精灯降低加热温度,以免浪费。答案:水浴;打开活塞放下浓盐酸并点燃酒精灯;黄绿色气体;控制活塞减慢浓盐酸滴加速率或控制酒精灯降低加热温度;
(3)一氯乙酸和二氯乙酸的沸点相差较小,所以多次蒸馏后产品中仍含有少量的二氯乙酸;除去一氯乙酸中的少量二氯乙酸可通过重结晶实现。答案:二氯乙酸;重结晶。


科目:高中化学 来源: 题型:
【题目】向某Na2CO3、 NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中![]() 与-1gc(Ba2+)的关系如图所示,下列说法不正确的是
与-1gc(Ba2+)的关系如图所示,下列说法不正确的是

A. 该溶液中![]() <
<![]()
B. B、D、E三点对应溶液pH的大小顺序为B>D>E
C. A、B、C三点对应的分散系中,A点的稳定性最差
D. D点对应的溶液中一定存在2c(Ba2+)+c(Na+)+c(H+)=3c(CO32+)+c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量在计算中的应用
(1)有等质量的两气体O3和 O2 ,同温同压下的密度之比为______。
(2)有7.8gNa2R含Na+为0.2mol,则Na2R的摩尔质量为_____,R的相对原子质量为___。
(3)质量比为51:32:34的NH3、CH4、H2S,其物质的量之比为___,它们所含氢原子数之比为__,所含质子数之比为___。
(4)在150°C,m gNH4HCO3固体完全分解生成NH3、CO2、H2O,若所得混合气体对H2的相对密度为d,则用含m、d的代数式表示混合气体的物质的量为_________。
(5)某市售盐酸的质量分数为36.5%,密度为1.18g/cm3,该盐酸的物质的量浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。总反应为![]() 。下列说法中正确的是
。下列说法中正确的是

A. a电极反应为:![]()
B. b为阳极,发生氧化反应
C. 电解一段时间b极区溶液pH升高
D. 废水中每通过6mol电子,a电极产生1molN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)明矾净水原理___________________________________(离子方程式表示),胶体具有________________性。
(2)在25℃时,将pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为___________
(3)NH4Cl溶液显______________(填“酸性”、“中性”或“碱性”),理由是_________(用离子方程式或必要的文字说明).
(4)NaHCO3溶液中,下列表述正确的是_______
A.c(Na+) + c(H+)= c(HCO3﹣)+ c(CO32﹣)+ c(OH﹣)
B. c(OH﹣)= c(H2CO3)+ c(H+)-c(CO32﹣)
C.c(OH﹣)= c(HCO3﹣)+ c(H+)+c(H2CO3)
D.c (Na+)= c(HCO3﹣)+ c(CO32﹣) + c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种:K+ 、NO3-、SO42-、NH4+、CO32-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g
下列说法正确的是
A.该溶液中无法确定是否含有K+
B.该溶液中肯定含有NO3-、SO42-、NH4+、CO32-
C.不能确定该溶液中是否含有NO3-
D.该溶液中一定含有K+,且c(K+)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
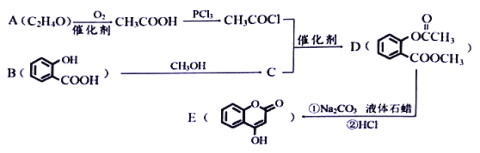
(1)有机物A结构简式为___________。B的名称为___________。
(2)C转化为D的反应类型是___________。
(3)写出E与足量NaOH溶液完全反应的化学方程式___________
(4)1moD完全水解且酸化后,所得有机物与足量 NaHCO3溶液反应生成CO2物质的量为___________。
(5)写出同时满足下列条件的C的同分异构体的结构简式___________。
①苯环上只有两个取代基,且除苯环外无其他环状结构
②核磁共振氢谱只有5个峰
③能与FeCl3溶液发生显色反应
④能水解并能与银氨溶液反应
(6)已知:酚羟基一般不易直接与羧酸酯化,甲苯可被酸性高锰酸钾溶液氧化为苯甲酸。试参照上述合成路线图,写出以苯酚、甲苯为原料制取苯甲酸苯酯(![]() )的合成路线(无机原料任选)___________。
)的合成路线(无机原料任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子中质子、中子、电子的数量、质量和电性之间存在一定的相互关系。请填写下列空白:
(1)质子数决定________的种类;质子数和中子数决定________的种类。
(2)![]() 代表一个质量数为________、质子数为______、中子数为________、核外电子数为________的原子。
代表一个质量数为________、质子数为______、中子数为________、核外电子数为________的原子。
(3)质量数=________+________,对任一原子,核电荷数=________;对中性原子,核外电子数=________。
(4)ZXn-中核外电子数=________,ZXn+中核外电子数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com