
【题目】某溶液中只可能含有下列离子中的几种:K+ 、NO3-、SO42-、NH4+、CO32-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g
下列说法正确的是
A.该溶液中无法确定是否含有K+
B.该溶液中肯定含有NO3-、SO42-、NH4+、CO32-
C.不能确定该溶液中是否含有NO3-
D.该溶液中一定含有K+,且c(K+)=0.1mol/L
【答案】C
【解析】
实验1:第一份加入足量的烧碱并加热会产生气体证明含有NH4+;实验2:第二份先加入足量的盐酸,无现象,则不含有CO32-,再加足量的BaCl2溶液,得固体2.33g,证明含有SO42-。
根据实验1:第一份加入足量的烧碱并加热,会产生气体224mL,证明含有NH4+,且物质的量为0.01mol;
实验2:第二份先加入足量的盐酸,无现象,则一定不含有CO32-,再加足量的BaCl2溶液,得固体2.33g,证明一定含有SO42-,且物质的量为:![]() =0.01mol,根据溶液中的电荷守恒,则一定含有钾离子,且钾离子的浓度≥
=0.01mol,根据溶液中的电荷守恒,则一定含有钾离子,且钾离子的浓度≥![]() =0.1mol/L.
=0.1mol/L.
A、根据电荷守恒,该溶液中一定含有K+,故A错误;
B、该溶液中肯定含有NH4+、SO42-、K+,肯定不含CO32-,故B错误;
C、根据以上分析,该溶液中可能含有NO3-,故C正确;
D、溶液中NH4+物质的量为0.01mol,SO42-物质的量为0.01mol,可能含有硝酸根离子,根据电荷守恒,溶液中一定含有K+,且c(K+)≥0.1mol/L,故D错误。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。下列有关说法不正确的是
A. 制冷剂氟里昂-12(CCl2F2)的研发利用,充分体现了元素周期表的指导作用
B. 通过测定物质中![]() 的含量可以推断文物的年代
的含量可以推断文物的年代
C. 门捷列夫预言的“类铝” 镓(Ga)元素的发现,证实了元素周期律的科学性
D. 过渡元素Ti、Mo、W等的单质有耐高温,耐腐蚀的特点,其合金可以制造火箭、导弹、宇宙飞船等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制240mL 1.2mol/L的NaOH溶液,填空请回答下列问题:
(1)配制240mL 1.2mol/L的NaOH溶液
应称取NaOH的质量/g | 选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
_________ | ________ | _______ |
(2)容量瓶上需标有以下五项中的_____________________;
①浓度 ② 温度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___;
A.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
B.用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G 装入贴好标签的试剂瓶待用
(4)下列配制的溶液浓度偏低的是__;
A.称量NaOH时,在滤纸上称量
B.配制前,容量瓶中有少量蒸馏水
C.加蒸馏水时不慎超过了刻度线
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E 容量瓶在使用前烘干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯乙酸(ClCH2-COOH)在有机合成中是一种重要的原料和中间体,在硫单质催化下干燥氯气与乙酸反应制得一氯乙酸:![]()
![]()
![]()
已知:

请回答下列问题:
(1)选用下图的装置制备一氯乙酸粗品。

①按照气流从左至右依次连接的合理顺序为____→____→____→____→____→i→j→g→h(填接口字母)。____
②洗气瓶中的溶液为____,碱石灰的作用是____。
(2)制备一氯乙酸时,首先采用____(填“水浴”、“油浴”或“沙浴”)加热方法控制温度在95℃左右,待温度稳定后,再打开弹簧夹、____(填操作),如果三颈烧瓶溶液表面观察到大量 ___(填现象)时,应该___(填操作),以减少氯气通入量,以免浪费。
(3)一氯乙酸粗品中含有二氯乙酸、三氯乙酸,多次蒸馏后产品中仍含有少量的____(填物质名称),再进行____(填“过滤”、“分液”或“重结晶”),可得到纯净的一氯乙酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。实验装置如下图所示(图中夹持、固定用的仪器未画出)。下列说法正确的是

A. 乙装置中盛放的是饱和食盐水
B. 丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出
C. 丁装置中倒扣的漏斗主要作用是防止产生的气体污染空气
D. 实验结束后,分离碳酸氢钠的操作是蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内最新研究,实现CO2的固定和储能的多功能电化学反应装置,如图所示。该装置充放电过程并不完全可逆,即充电过程C不参与反应。放电过程反应方程式为:4Li+3CO2=2Li2CO3+C,下列叙述正确的是
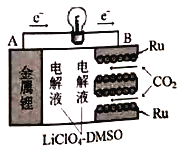
A. 放电过程正极反应式为4Li++3CO2+4e-=2Li2CO3+C
B. 若放电过程转移电子物质的量为0.2mol,理论上可以固定C的质量为1.2g
C. 充电过程B电极为阴极,发生氧化反应
D. 可用 LiClO4水溶液代替LiClO4-DMSO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氟磷灰石[主要成分Ca5(PO4)3F生产磷酸主要有热法和湿法两种方法。其流程如下:

热法:工业上将氟磷灰石、焦炭和石英砂(SiO2)混合后,在电炉中加热到1500℃生成白磷(P4)、SiF4、CO,白磷在空气中燃烧生成五氧化二磷,再经水化制成粗磷酸。
湿法:武汉化工研究院为技术攻关,实验室模拟生产磷酸的流程。
(1)配平步骤I反应的化学方程式:
____Ca5(PO4)3F+ ____C+ ____SiO2=____SiF4↑+ ___P4+____CO↑+____CaSiO3。其中氧化剂是______。
(2)湿法中粉碎氟磷灰石的目的是___________。
(3)浸取槽中发生反应的化学方程式________;浸取槽不能使用玻璃器皿的原因___________。
(4)探究中发现,65℃、一定流速下鼓气(鼓气可减少盐酸与氟磷灰石矿反应过程中液面的泡沫,利于HF逸出),并通过控制盐酸的用量减少后续除氟工艺。其他条件不变,盐酸实际用量/理论用量与所得的磷酸中氟含量及磷酸的浸取率如图所示。

①选择盐酸用量:盐酸实际用量/理论用量的范围为________(填字母代号)时磷酸浸取率较高且氟含量较低。
A.0.95~1.00 B.1.00~1.05
C. 1.05~1.10 D.1.15~1.20
②盐酸稍过量,氟含量降低的原因是___________。
③盐酸过量较多,氟含量快速增加的可能原因是___________。
(5)通过双指示剂方法测定浸取液中盐酸和磷酸的浓度。实验如下:每次取10.0mL浸取液,用1.0 mol·L-1NaOH溶液滴定,分别用不同的指示剂,滴定结果见表。含磷微粒在不同pH下物质的量分数如图所示。(甲基橙的变色范围为3.1~4.4,百里酚酞的变色范围为9.4~10.6)


则浸取液中c(HCl)=___________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3—O2碱性燃料电池的示意图如下,有关说法正确的是

A. a极每产生1molN2,约有6×6.02×1023个OH-迁移至b极
B. a极的电极反应为:2NH3 -6e- = N2+ 6H+
C. b极的电极反应为:4OH- -4e- = 2H2O + O2↑
D. 该电池总反应为:4NH3 + 3O2 = 2N2 + 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2+I2+2H2O===H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________;当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com