
【题目】NH3—O2碱性燃料电池的示意图如下,有关说法正确的是

A. a极每产生1molN2,约有6×6.02×1023个OH-迁移至b极
B. a极的电极反应为:2NH3 -6e- = N2+ 6H+
C. b极的电极反应为:4OH- -4e- = 2H2O + O2↑
D. 该电池总反应为:4NH3 + 3O2 = 2N2 + 6H2O
科目:高中化学 来源: 题型:
【题目】物质的量在计算中的应用
(1)有等质量的两气体O3和 O2 ,同温同压下的密度之比为______。
(2)有7.8gNa2R含Na+为0.2mol,则Na2R的摩尔质量为_____,R的相对原子质量为___。
(3)质量比为51:32:34的NH3、CH4、H2S,其物质的量之比为___,它们所含氢原子数之比为__,所含质子数之比为___。
(4)在150°C,m gNH4HCO3固体完全分解生成NH3、CO2、H2O,若所得混合气体对H2的相对密度为d,则用含m、d的代数式表示混合气体的物质的量为_________。
(5)某市售盐酸的质量分数为36.5%,密度为1.18g/cm3,该盐酸的物质的量浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种:K+ 、NO3-、SO42-、NH4+、CO32-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g
下列说法正确的是
A.该溶液中无法确定是否含有K+
B.该溶液中肯定含有NO3-、SO42-、NH4+、CO32-
C.不能确定该溶液中是否含有NO3-
D.该溶液中一定含有K+,且c(K+)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
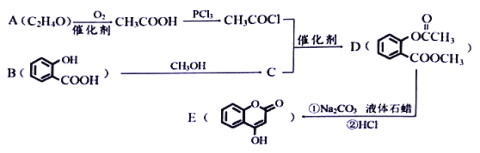
(1)有机物A结构简式为___________。B的名称为___________。
(2)C转化为D的反应类型是___________。
(3)写出E与足量NaOH溶液完全反应的化学方程式___________
(4)1moD完全水解且酸化后,所得有机物与足量 NaHCO3溶液反应生成CO2物质的量为___________。
(5)写出同时满足下列条件的C的同分异构体的结构简式___________。
①苯环上只有两个取代基,且除苯环外无其他环状结构
②核磁共振氢谱只有5个峰
③能与FeCl3溶液发生显色反应
④能水解并能与银氨溶液反应
(6)已知:酚羟基一般不易直接与羧酸酯化,甲苯可被酸性高锰酸钾溶液氧化为苯甲酸。试参照上述合成路线图,写出以苯酚、甲苯为原料制取苯甲酸苯酯(![]() )的合成路线(无机原料任选)___________。
)的合成路线(无机原料任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温下,pH =1的盐酸中含有H+的数目为0.1NA
B. 标准状况下,22.4 LCl2与Fe完全反应时,转移电子数为3NA
C. 32gO2和32gO3中所含原子数均为2NA
D. 常温常压下,28 g乙烯含有2NA个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①菱锰矿石主要成分是![]() ,还含有少量Fe、Al、Ca、Mg等元素;
,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子![]() 形成氯氧化物沉淀时的pH如下:
形成氯氧化物沉淀时的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下, ![]() 的溶度积分别为
的溶度积分别为![]()
回答下列问题:
(1)“焙烧”时发生的主要化学反应方程式为_____________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:

焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入![]() 氧化为
氧化为![]() ,反应的离子方程式为________;然后调节溶液pH使
,反应的离子方程式为________;然后调节溶液pH使![]() 沉淀完全,此时溶液的pH范围为____。再加入
沉淀完全,此时溶液的pH范围为____。再加入![]() 沉淀
沉淀![]() ,当
,当![]() 时,
时, ![]() =______
=______![]()
(4)碳化结晶时,发生反应的离子方程式为___________。
(5)流程中能循环利用的固态物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒醛衍生物在香料、农药、医药等领域有着广泛用途,A为香草醛,以A为原料合成5-三氟甲基胡椒醛(E)的路线如图所示:

已知:
(1)反应①的类型是 。
(2)写出A中含氧官能团的名称 。
(3)写出反应③的化学方程式 。
(4)写出满足下列条件A的一种同分异构体的结构简式 。
①能与碳酸氢钠溶液反应放出气体
②不与氯化铁溶液发生显色反应
③含苯环,核磁共振氢谱显示其有5种不同化学环境的氢原子
(5)以A和2-氯丙烷为原料,可合成香草醛缩丙二醇( ),写出合成流程图(无机试剂任用)。合成流程图示例如下:
),写出合成流程图(无机试剂任用)。合成流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子中质子、中子、电子的数量、质量和电性之间存在一定的相互关系。请填写下列空白:
(1)质子数决定________的种类;质子数和中子数决定________的种类。
(2)![]() 代表一个质量数为________、质子数为______、中子数为________、核外电子数为________的原子。
代表一个质量数为________、质子数为______、中子数为________、核外电子数为________的原子。
(3)质量数=________+________,对任一原子,核电荷数=________;对中性原子,核外电子数=________。
(4)ZXn-中核外电子数=________,ZXn+中核外电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com