
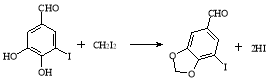
【题目】胡椒醛衍生物在香料、农药、医药等领域有着广泛用途,A为香草醛,以A为原料合成5-三氟甲基胡椒醛(E)的路线如图所示:

已知:
(1)反应①的类型是 。
(2)写出A中含氧官能团的名称 。
(3)写出反应③的化学方程式 。
(4)写出满足下列条件A的一种同分异构体的结构简式 。
①能与碳酸氢钠溶液反应放出气体
②不与氯化铁溶液发生显色反应
③含苯环,核磁共振氢谱显示其有5种不同化学环境的氢原子
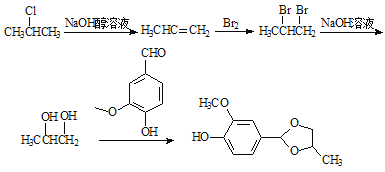
(5)以A和2-氯丙烷为原料,可合成香草醛缩丙二醇( ),写出合成流程图(无机试剂任用)。合成流程图示例如下:
),写出合成流程图(无机试剂任用)。合成流程图示例如下:![]()
【答案】(1)取代反应(2)醛基、羟基、醚键
(3) (4)
(4)![]()
(5)
【解析】
试题分析:(1)分析流程知反应①是碘原子取代了苯环的一个氢原子,反应类型是取代反应。(2)根据A的结构简式知A中含氧官能团的名称醛基、羟基、醚键。(3)根据题给信息知,反应③发生的是类似题给信息的取代反应,化学方程式为 。(4)A的分子式为C8H8O3,其同分异构体①能与碳酸氢钠溶液反应放出气体,可知含有羧基;②不与氯化铁溶液发生显色反应,无酚羟基;③含苯环,核磁共振氢谱显示其有5种不同化学环境的氢原子,说明有5种氢原子。满足这三个条件的结构简式为
。(4)A的分子式为C8H8O3,其同分异构体①能与碳酸氢钠溶液反应放出气体,可知含有羧基;②不与氯化铁溶液发生显色反应,无酚羟基;③含苯环,核磁共振氢谱显示其有5种不同化学环境的氢原子,说明有5种氢原子。满足这三个条件的结构简式为![]() 。(5)要得到目标物香草醛缩丙二醇(
。(5)要得到目标物香草醛缩丙二醇(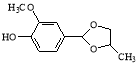 ),由此进行逆向推断,首先要得到1,2—丙二醇和香草醛,而这两种物质的反应类似于信息中的反应。再由1,2—丙二醇反推得到上一步物质为1,2—二溴丙烷,再反推得上一步物质为CH3CH=CH2 ,继续推得原料为2-氯丙烷。成路线见答案。
),由此进行逆向推断,首先要得到1,2—丙二醇和香草醛,而这两种物质的反应类似于信息中的反应。再由1,2—丙二醇反推得到上一步物质为1,2—二溴丙烷,再反推得上一步物质为CH3CH=CH2 ,继续推得原料为2-氯丙烷。成路线见答案。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制240mL 1.2mol/L的NaOH溶液,填空请回答下列问题:
(1)配制240mL 1.2mol/L的NaOH溶液
应称取NaOH的质量/g | 选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
_________ | ________ | _______ |
(2)容量瓶上需标有以下五项中的_____________________;
①浓度 ② 温度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___;
A.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
B.用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G 装入贴好标签的试剂瓶待用
(4)下列配制的溶液浓度偏低的是__;
A.称量NaOH时,在滤纸上称量
B.配制前,容量瓶中有少量蒸馏水
C.加蒸馏水时不慎超过了刻度线
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E 容量瓶在使用前烘干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氟磷灰石[主要成分Ca5(PO4)3F生产磷酸主要有热法和湿法两种方法。其流程如下:

热法:工业上将氟磷灰石、焦炭和石英砂(SiO2)混合后,在电炉中加热到1500℃生成白磷(P4)、SiF4、CO,白磷在空气中燃烧生成五氧化二磷,再经水化制成粗磷酸。
湿法:武汉化工研究院为技术攻关,实验室模拟生产磷酸的流程。
(1)配平步骤I反应的化学方程式:
____Ca5(PO4)3F+ ____C+ ____SiO2=____SiF4↑+ ___P4+____CO↑+____CaSiO3。其中氧化剂是______。
(2)湿法中粉碎氟磷灰石的目的是___________。
(3)浸取槽中发生反应的化学方程式________;浸取槽不能使用玻璃器皿的原因___________。
(4)探究中发现,65℃、一定流速下鼓气(鼓气可减少盐酸与氟磷灰石矿反应过程中液面的泡沫,利于HF逸出),并通过控制盐酸的用量减少后续除氟工艺。其他条件不变,盐酸实际用量/理论用量与所得的磷酸中氟含量及磷酸的浸取率如图所示。

①选择盐酸用量:盐酸实际用量/理论用量的范围为________(填字母代号)时磷酸浸取率较高且氟含量较低。
A.0.95~1.00 B.1.00~1.05
C. 1.05~1.10 D.1.15~1.20
②盐酸稍过量,氟含量降低的原因是___________。
③盐酸过量较多,氟含量快速增加的可能原因是___________。
(5)通过双指示剂方法测定浸取液中盐酸和磷酸的浓度。实验如下:每次取10.0mL浸取液,用1.0 mol·L-1NaOH溶液滴定,分别用不同的指示剂,滴定结果见表。含磷微粒在不同pH下物质的量分数如图所示。(甲基橙的变色范围为3.1~4.4,百里酚酞的变色范围为9.4~10.6)


则浸取液中c(HCl)=___________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3—O2碱性燃料电池的示意图如下,有关说法正确的是

A. a极每产生1molN2,约有6×6.02×1023个OH-迁移至b极
B. a极的电极反应为:2NH3 -6e- = N2+ 6H+
C. b极的电极反应为:4OH- -4e- = 2H2O + O2↑
D. 该电池总反应为:4NH3 + 3O2 = 2N2 + 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知: ![]()
![]()
![]()
则煤气化主要反应![]() ________________
________________
(2)已知![]() 的正反应速率为
的正反应速率为![]() ,逆反应速率为
,逆反应速率为![]() ,k为速率常数。2500K时,
,k为速率常数。2500K时, ![]() ,则该温度下的反应平衡常数K=_________________ 。
,则该温度下的反应平衡常数K=_________________ 。
(3)甲醇制甲醚的有关反应为: ![]() 一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH | CH3OCH3 | H2O | ||
I | 387 | 0. 20 | x | |
II | 387 | 0. 40 | y | |
Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
![]() ________________.
________________.
②已知![]() 时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol
时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol ![]() ,则反应将向_________(填“正”或“逆”)反应方向进行。
,则反应将向_________(填“正”或“逆”)反应方向进行。
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为______________(填序号)
A.升高温度 B.其他条件不变,增加![]() 的物质的量
的物质的量
C.降低温度 D.保持其他条件不变,通入氖气
(4)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中![]() 及
及![]() 的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:
的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:

①当空/燃比达到15后![]() 减少的原因可能是__________(填字母)。
减少的原因可能是__________(填字母)。
a.反应![]() 是吸热反应
是吸热反应
b.当空/燃比大干15后,燃油气燃烧放出的热量相应减少
②随空/燃比增大,CO和![]() 的含量减少的原因是______。
的含量减少的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用图9所示装置制备1,2二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:

(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式 ;该反应类型为 。
(2)写出制备1,2二溴乙烷的化学方程式 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(4)容器c中NaOH溶液的作用是 ;e装置内NaOH溶液的作用是 。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010 mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是___________________,“沉渣2”的主要成分是_____,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________。
(2)用离子方程式解释加入NH4F “除Ca”的过程________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3:2,此时Ni单质所发生的化学方程式为_______。
(4)“操作X”是________、________
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为__________________。
(6)根据上表数据,计算当0.010 mol/L NiSO4溶液中Ni2+完全沉淀时的c(Ni2+)= ____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2+I2+2H2O===H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________;当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号 | 加入试剂 | 实验现象 |
Ⅰ | 4 mL 2 mol·L-1HCl 溶液 | 沉淀溶解 |
Ⅱ | 4 mL 2 mol·L-1NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程_____________。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因___________。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是_________。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是____________。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是___________。
③乙同学这样配制混合溶液的理由是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com