
铁及其化合物与生产、生活关系密切。
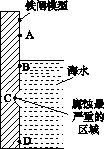
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
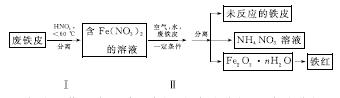
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
(3)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO, t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
(1)①吸氧腐蚀 ②B
(2)①4HNO3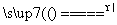 4NO2↑+O2↑+2H2O ②4Fe+10HNO3===4Fe(NO3)2+NH4NO3+3H2O ③氮氧化物排放少(或其他合理答案) (3)①4∶1 ②0.05
4NO2↑+O2↑+2H2O ②4Fe+10HNO3===4Fe(NO3)2+NH4NO3+3H2O ③氮氧化物排放少(或其他合理答案) (3)①4∶1 ②0.05
[解析] (1)①若为析氢腐蚀则B、C、D的腐蚀程度相同,则该电化学腐蚀为吸氧腐蚀。②氧气的浓度越大,吸氧腐蚀越严重,则B区域产生铁锈最多。(2)①硝酸的受热分解产生NO2、O2、H2O ,则根据氧化还原的化合价升降法配平其化学方程式为4HNO3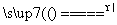 4NO2↑+O2↑+2H2O。②根据图示和信息可知:该生产流程中生成了 NH4NO3,则硝酸与废铁皮反应的化学方程式为 4Fe+10HNO3===4Fe(NO3)2+ NH4NO3+3H2O。
4NO2↑+O2↑+2H2O。②根据图示和信息可知:该生产流程中生成了 NH4NO3,则硝酸与废铁皮反应的化学方程式为 4Fe+10HNO3===4Fe(NO3)2+ NH4NO3+3H2O。
(3)①在t ℃时,K=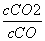 =
= =0.25,则
=0.25,则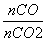 =4。
=4。
② FeO(s)+ CO(g)  Fe(s)+CO2(g)
Fe(s)+CO2(g)
n起始/mol 0.02 x 0 0
n转化/mol 0.01 0.01 0.01 0.01
n平衡/mol 0.01 x-0.01 0.01 0.01
根据t ℃时,K= 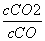 =
=  =
=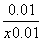 =0.25 ,求得x=0.05。
=0.25 ,求得x=0.05。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于物质应用和组成的说法正确的是( )
A.P2O5可用于干燥Cl2和NH3
B.“可燃冰”主要成分是甲烷和水
C.CCl4可用于鉴别溴水和碘水
D.Si和SiO2都用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
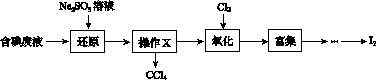
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________________;该操作将I2还原为I-的目的是______________________。
(2)操作X的名称为________。
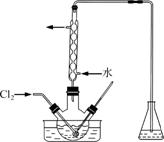
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是______________;锥形瓶里盛放的溶液为________。
(4)已知:5SO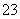 +2IO
+2IO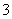 +2H+===I2+5SO
+2H+===I2+5SO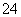 +H2O
+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO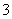 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO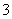 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;________________________________________________________________________
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)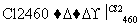 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)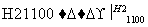 Si(纯)
Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
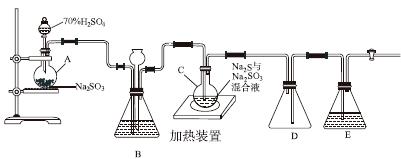
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)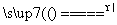 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O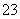 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.某气体能使品红溶液褪色,则该气体是SO2
B.向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中有Cl-
C.向某溶液中加入Ba(NO3)2溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中有SO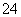
D.向某溶液中加入NaOH并加热,产生可使湿润的红色石蕊试纸变蓝的气体,则原溶液中有NH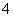
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~6 min的平均反应速率:
v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6 min时,c(H2O2)=0.30 mol/L
D.反应至6 min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com