
| ||
| ||
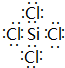 ,故答案为:
,故答案为: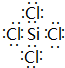 .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、空气中的小水滴颗粒直径大小约为1nm~100nm |
| B、光是一种胶体 |
| C、雾是一种胶体 |
| D、发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
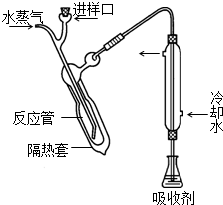 凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
凯氏定氮法测定奶粉中蛋白质含量的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
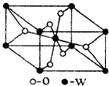 原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.查看答案和解析>>
科目:高中化学 来源: 题型:

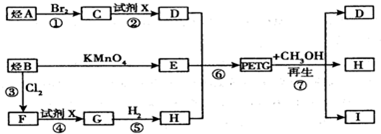 这种材料可采用如图所示的合成路线已知:(1)
这种材料可采用如图所示的合成路线已知:(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
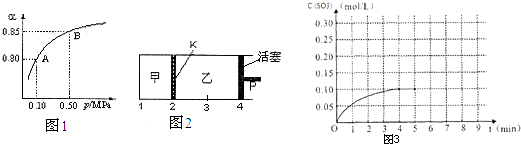
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
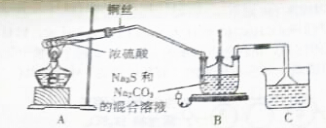
| 实验步骤 | 预期现象和结论 |
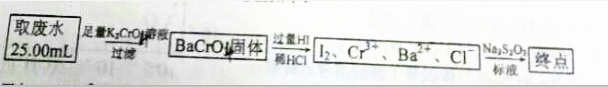
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com