
����Ŀ�������Ǽ�����Ҫ�Ļ���ԭ�ϣ��ڹ�ҵ��ũҵ��ҽҩ�����µ�����Ӧ�ù㷺����ҵ��ͨ���ýӴ��������ᣬ��Ҫԭ����������Ϳ������Ӵ�����������������̴��¿� ��Ϊ�����Σ������������ȡ�;�������������ת��Ϊ��������������������պ���������ɡ�Ϊ�˷�ֹ������Ⱦ����β�������ۺ����ã����᳧���ð�ˮ����β���� SO2��SO3 �����壬��������Һ�м���Ũ���ᣬ����ȡ��Ũ�ȵ� SO2 ��(NH4)2SO4��NH4HSO4���塣Ϊ�˲ⶨ�ⶨ����(NH4)2SO4��NH4HSO4�����������ɣ��ֳ�ȡ����Ʒ�ķݣ��ֱ� ������ͬŨ�ȵ� NaOH ��Һ 50.00 mL�������� 120�����ң�ʹ����ȫ���ݳ���(NH4)2SO4��NH4HSO4�ķֽ��¶Ⱦ����� 200���ݣ�����й�ʵ���������£���״������
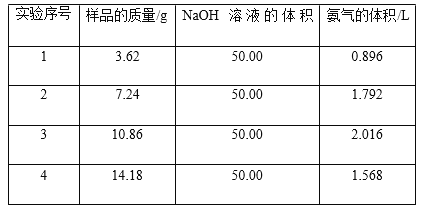
��1���� 1 ������ֱ���Ʋ⣺1.81 g ��Ʒ����ͬ��ʵ��ʱ�����ɰ������������״����Ϊ L��
��2���Լ���û������(NH4)2SO4��NH4HSO4�����ʵ���֮��Ϊ ��
��3�������� NaOH ��Һ�����ʵ���Ũ�� ��
���𰸡���1��0.448 ��2��1�U2 ��3��3mol��L��1
��������
�����������1���� 1 ��2�����ݿ�֪����������������1.81 g ��Ʒ����ͬ��ʵ��ʱ�����ɰ������������״����Ϊ0.896L��2��0.448L��
��2�����ݵ�1����2��������֪���������������裨NH4��2SO4���ʵ���Ϊxmol��NH4HSO4���ʵ���Ϊymol����������NH4��2SO4~2NH3��NH4HSO4~NH3��֪��132x+115y=7.24��2x+y= 1.792��22.4��ã�x=0.02 mol��y=0.04mol�����n��(NH4)2SO4����n��NH4HSO4��=1��2��
��3�����������ݿ�֪4��ʵ������������������14.48g�û��������n[��NH4��2SO4]=0.004mol��n(NH4HSO4)=0.008mol��������е�NH4+Ϊ0.16 mol��H+Ϊ0.08 mol����Ӧ�����η�����Ӧ��
H����OH��=H2O
0.08 0.08
NH4����OH��=NH3��+H2O
0.07 0.07 0.07
�����������Ƶ�Ũ����0.15 mol��0.05L��3 mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������2H++CO32���TCO2��+H2O��ʾ�ķ�Ӧ�ǣ� ��
A.������Һ��̼������Һ��Ӧ
B.ϡ������̼������Һ��Ӧ
C.ϡ������̼�����Һ��Ӧ
D.����������Һ��̼�����Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶�������2molSO2��1molO2����һ�̶��ݻ����ܱ������У��ڴ��������·������·�Ӧ��2SO2��g��+O2��g�� ![]() 2SO3��g�� ��H=-197kJ/mol�����ﵽ��ѧƽ��ʱ������˵������ȷ����
2SO3��g�� ��H=-197kJ/mol�����ﵽ��ѧƽ��ʱ������˵������ȷ����
A��SO2��SO3��2mol B������ SO32mol
C���ų�197kJ���� D������ԭ�ӹ�8mo1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵķ���������ǣ� ��
A.�������Ͻ𩁱Ƚ�Ӳ��
B.��ˮ�����Ȼ��ƺ�����粒���
C.��ȼ�յķ���������ë�͵���
D.��ȼ�ŵ�ľ���������������̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҵ��������ˮ������������Ҫ�о����⡣��������������ʳ�����������������Ĺ�����ˮ(���Ҵ��������������������ᡢ���Ѻʹ�����������)�������õ��ӹ�ҵ����[��SiO2��Cu2(OH)2CO3]����ͭ�Ĺ�����ơ��ش��������⣺
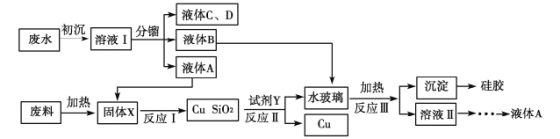
(1)����������Լ���������д�����뾻ˮ�����ӵ�ˮ�ⷽ��ʽ��________________________��
(2)����X�ijɷ���__________����Ӧ��Ļ�ѧ��Ӧ����ʽ____________________��
(3)�Լ�YΪ__________���ӿ췴Ӧ�����ʵĴ�ʩ��__________________(��дһ��)��
(4)��Ӧ������ӷ���ʽΪ______________________��
(5)�轺����������������;�㷺��д������һ����;��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ�ҵ��������Ҫ����;��ij��ȤС����ʵ������������װ��ģ�ҵ���������Ʊ���ˮ�Ȼ�����183��ʱ����������ʪ����������������������
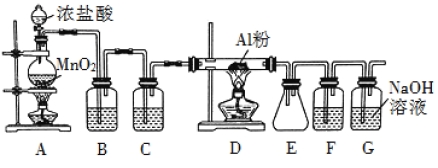
��ش��������⣺
��1��װ�� B ��ʢ�ű���ʳ��ˮ���������� ��F ��ʢ�ŵ��� ���������� ����һ������װ���ʵ��Լ���Ҳ���� F �� G �����ã���װ����Լ�Ϊ ��
��2��װ�� A ʵ�鿪ʼʱ���ȼ��װ�������ԣ��������IJ��������� ������ţ���
A������ƿ�м��� MnO2 ��ĩ B������ C������ƿ�м���Ũ����
��3���Ʊ���Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȣ�̽��С��ͬѧ ����ܶ�ʵ�鷽�������з���֮һΪ�ò�����Һ�������� Zn ��Ӧ���������ɵ� H2����� װ����ͼ��ʾ���г���������ȥ������Ӧ��ϣ�ÿ��� 1 ���Ӷ�ȡ������������������С��ֱ�����䡣���������μ�С��ԭ���� ���ų�������ʵ�������Ӱ�����أ���
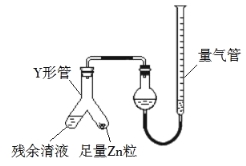
��4����С��ͬѧ�����ϵ�֪��������ع����Ũ������Ҳ������������ͬʱ�д��� ClO2 ���ɣ�ClO2 �е�Ϊ 10 �����۵�Ϊ59 ����Һ��Ϊ��ɫ��Cl2 �е�Ϊ34 ����Һ̬Ϊ����ɫ��������ʵ����֤ Cl2�к��� ClO2�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3��22���ǡ�����ˮ�ա��������й�ˮ��������ȷ���ǣ� ��
A.������������ˮ����������
B.���ˮʱ����������������������
C.�����������Ե�����ˮ
D.ˮֱ������ԭ�Ӻ���ԭ�ӹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ȼ�����������������Ӧ�ù㷺��
(1)�Ȼ�����ˮ���γɾ��о�ˮ���õ������������壬�䷴Ӧ�����ӷ���ʽΪ__________________
(2)��ҵ����������(��Ҫ�ɷ�ΪAl2O3������Fe2O3��SiO2������)��ȡ��ˮ�Ȼ�����һ�ֹ�������ʾ�����£�
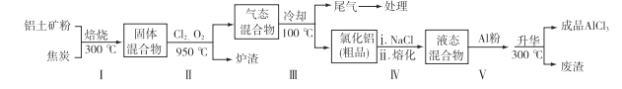
��֪��
���� | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
�е�/�� | 57.6 | 180(����) | 300(����) | 1 023 |
���������б���ʹ����ˮ�ֻӷ���������Ŀ���࣬��������________(ֻҪ��д��һ��)��
��������������ͨ����������������Ӧ�������ԭ�������ȹ��ĵ�����________��
����֪��
Al2O3(s)��3C(s)===2Al(s)��3CO(g)
��H1����1 344.1 kJ��mol��1
2AlCl3(g)===2Al(s)��3Cl2(g)
��H2����1 169.2 kJ��mol��1
��Al2O3��C��Cl2��Ӧ����AlCl3���Ȼ�ѧ����ʽΪ_______________________��
����������β������ȴ�����º�������������NaOH����Һ���գ����ɵ�����Ҫ��3�֣��仯ѧʽ�ֱ�Ϊ____________��
��������̼�������ݷ������������м������۵�Ŀ����_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������10.0g̼���ƺ�̼�����ƵĻ�������������ٱ仯��ʣ����������Ϊ8.45g����������̼���Ƶ�����������( )
A. 58�� B. 42�� C. 36�� D. 64��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com