
【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为__________________
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
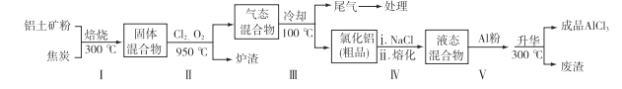
已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1 023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是________(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是________。
③已知:
Al2O3(s)+3C(s)===2Al(s)+3CO(g)
ΔH1=+1 344.1 kJ·mol-1
2AlCl3(g)===2Al(s)+3Cl2(g)
ΔH2=+1 169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为_______________________。
④步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为____________。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_______________________。
【答案】(1)Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
(2)①防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率
②铁或Fe
③Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g) ΔH=+174.9 kJ·mol-1
④NaCl、NaClO、Na2CO3
⑤除去FeCl3,提高AlCl3纯度
【解析】(1)Al3+水解生成Al(OH)3和H+。
(2)①水分减少可防止Al3+的水解,气孔数目增多,增大了接触面积,可以加快反应速率;②焦炭能还原矿石中的铁;③根据盖斯定律,将第一个反应减去第二个反应可得该热化学反应方程式;④尾气中存在Cl2和CO2,故与NaOH溶液反应生成NaCl、NaClO、Na2CO3;⑤根据工艺流程示意图可知液态混合物中含有FeCl3杂质,因此加入铝粉可除去FeCl3,提高AlCl3的纯度。


科目:高中化学 来源: 题型:
【题目】硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可 分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的 SO2、SO3 等气体,再向吸收液中加入浓硫酸,以制取高浓度的 SO2 及(NH4)2SO4和NH4HSO4固体。为了测定测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别 加入相同浓度的 NaOH 溶液 50.00 mL,加热至 120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于 200℃],测得有关实验数据如下(标准状况):
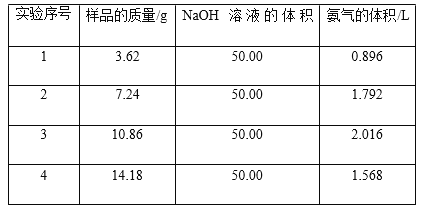
(1)由 1 组数据直接推测:1.81 g 样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用 NaOH 溶液的物质的量浓度 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
(1) |
| 实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为_____________; 硫化亚铁处加水的目的是_________________。 |
(2) |
| 实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是______(必要时可以加热),该沉淀的化学式为_______________。 |
(4) |
| 实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是___________; ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为_______%(保留2位小数,已折算标况)。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不能增大锌与稀硫酸反应制氢气的化学反应速率的是
A. 改用热的稀硫酸溶液 B. 向该稀硫酸溶液中加几滴硫酸铜溶液
C. 用浓硫酸代替稀硫酸 D. 使用粗锌粒或使用锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
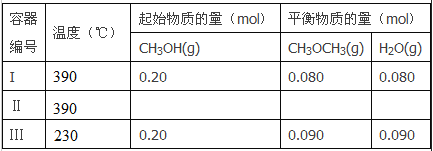
回答下列问题:
(1)反应的△H_________O(填“>”或“<”);判断的理由是_____________。
(2)容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为________mol/(L·s)。390℃时该反应的平衡常数K1=_________(填数值)。
(3)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为____________;平衡时CH3OH(g)的体积分数为__________。
(4)390℃,若向3L容器中充入0.9mol CH3OH(g), 0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正_____________V逆。(填“>”“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com