
【题目】下列物质的用途跟其化学性质相关的是( )
A.干冰用于人工降雨
B.铁粉用于食品保存
C.稀有气体用来制作电光源
D.铜用作电线
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】把a L含(NH4)2SO4和NH4NO3的混合液分成两等份。一份用b mol烧碱刚好把NH3全部赶出;
另一份与BaCl2溶液恰好完全反应,消耗c mol BaCl2,则原溶液中c(NO![]() )为( )
)为( )
A.![]() mol/L B.
mol/L B.![]() mol/L
mol/L
C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用2H++CO32﹣═CO2↑+H2O表示的反应是( )
A.醋酸溶液与碳酸钠溶液反应
B.稀硝酸与碳酸钠溶液反应
C.稀硫酸与碳酸钾溶液反应
D.硫酸氢钠溶液与碳酸钾溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2 下列关于该电池的说法错误的是

A.Mg电极的电极反应式:Mg-2e-=Mg2+
B.这种电池的工作原理可以认为是镁的吸氧腐蚀
C.活性炭电极上发生氧化反应
D.电池工作时实现了化学能向电能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
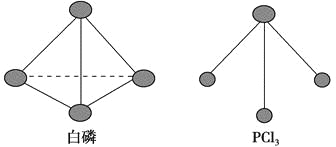
则反应P4(s,白磷)+6Cl2(g)==4PCl3(s)的反应热ΔH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂。制备硝基苯的过程如下:
①组装如下图反应装置。配制混酸,取100 mL烧杯,用20 mL 浓硫酸与18 mL浓硝酸配制混酸,加入漏斗中,把18 mL 苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀。
③在50~60 ℃下发生反应,直至反应结束。
④除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
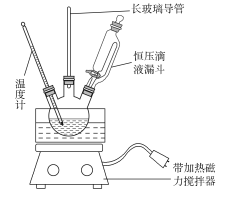
(2)可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃) /(g·cm-3) | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入________。
(2)恒压滴液漏斗的优点是__________________________________。
(3)实验装置中长玻璃导管可用________代替(填仪器名称)。
(4)反应结束后产品在液体的________层(填“上”或“下”),分离混酸和产品的操作方法为________________________________。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? __________________________。
(6)为了得到更纯净的硝基苯,还需先向液体中加入____________除去水,然后蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molSO2和1molO2充入一固定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-197kJ/mol,当达到化学平衡时,下列说法中正确的是
2SO3(g) △H=-197kJ/mol,当达到化学平衡时,下列说法中正确的是
A.SO2和SO3共2mol B.生成 SO32mol
C.放出197kJ热量 D.含氧原子共8mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列区别物质的方法错误的是( )
A.铝与铝合金﹣比较硬度
B.用水区别氯化钠和硝酸铵固体
C.用燃烧的方法区别羊毛和涤纶
D.用燃着的木条鉴别氮气与二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为__________________
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
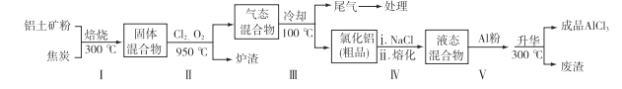
已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1 023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是________(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是________。
③已知:
Al2O3(s)+3C(s)===2Al(s)+3CO(g)
ΔH1=+1 344.1 kJ·mol-1
2AlCl3(g)===2Al(s)+3Cl2(g)
ΔH2=+1 169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为_______________________。
④步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为____________。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com