
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
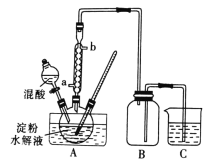
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%H2SO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________;步骤②中,水浴加热的优点为___________________。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___C6H12O6 + ___HNO3![]() ____+__________H2C2O4 + 9NO2↑ + 3NO↑+ ______。
____+__________H2C2O4 + 9NO2↑ + 3NO↑+ ______。
(3)称取m g草酸晶体粗产品,配成100 mL溶液。取20.00 mL于锥形瓶中,用a moL·L-1KMnO4标准液标定,只发生5H2C2O4 + 2MnO4- + 6H+ = 2Mn2+ + 10CO2↑ + 8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________。
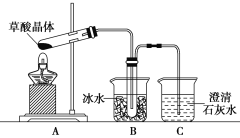
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择上述装置验证产物CO2,装置B的主要作用是__________。
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
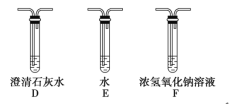
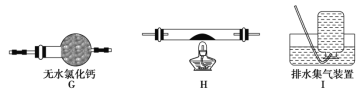
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________。其中装置H反应管中盛有的物质是________________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________。
【答案】分液漏斗 使受热均匀,便于控制温度 1 12 3 9 9H2O ![]() 使升华的草酸冷凝,避免对CO2检验的干扰 FDGHDI CuO H中黑色固体变红色,第一个D装置无现象,第二个D装置出现白色浑浊,即可证明
使升华的草酸冷凝,避免对CO2检验的干扰 FDGHDI CuO H中黑色固体变红色,第一个D装置无现象,第二个D装置出现白色浑浊,即可证明
【解析】
(1)根据仪器构造可知装混酸的仪器为分液漏斗;水浴加热的优点为:使受热均匀,便于控制温度,故答案为:分液漏斗;使受热均匀,便于控制温度;
(2)反应中碳元素化合价0价升高为+3价,电子转移18个,氮元素化合价+5价降低到+4价,电子转移1个,降低到+2价电子转移3个,结合化学方程式中系数和电子守恒和原子守恒配平的化学方程式:![]() ,故答案为:1;12;3;9;9H2O;
,故答案为:1;12;3;9;9H2O;
(3)称取mg草酸晶体粗产品,配成100mL溶液,取20.00mL于锥形瓶中,用amoLL1KMnO4标准液标定,只发生5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为VmL,100mL溶液中含草酸物质的量![]() ,则所得草酸晶体(H2C2O42H2O)的纯度=
,则所得草酸晶体(H2C2O42H2O)的纯度=![]() ,故答案为:
,故答案为:![]() ;
;
(4)草酸易挥发,导致生成的气体中含有草酸,草酸和氢氧化钙反应生成难溶性的草酸钙而干扰二氧化碳的检验,B装置温度较低,使升华的草酸冷凝,防止干扰二氧化碳的检验,故答案为:使升华的草酸冷凝,避免对CO2检验的干扰;
(5)①要检验生成CO,在甲组实验后,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验二氧化碳,用碱石灰干燥CO,利用CO和CuO发生还原反应生成CO2,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO避免环境污染,I中集气瓶收集到的气体主要是CO,所以其连接顺序是ABFDGHDI;H装置中盛放的物质应该具有氧化性,且和CO反应有明显现象发生,CuO能被CO还原且反应过程中黑色固体变为红色,现象明显,所以H中盛放的物质是CuO,故答案为:FDGHDI;CuO;
②CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊,且CO将黑色的CuO还原为红色的Cu,只要H中黑色固体转化为红色且第一个D装置无现象,第二个D装置出现白色浑浊就说明含有CO,故答案为:H中黑色固体变红色,第一个D装置无现象,第二个D装置出现白色浑浊,即可证明。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O=MnOOH+OH-,下列说法正确的是

A.铝电极上的电极反应式:Al-3e-=Al3+
B.电池工作时,NH4+移向石墨电极
C.每消耗2.7g铝就会有0.3mol电子通过溶液转移到正极上
D.放电过程中正极附近溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:
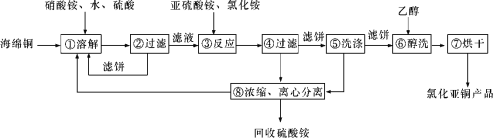
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:____________________________________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是__________(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是_____________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:_____。
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是____________________________________;温度过高、pH过大也会影响CuCl产率的原因是_______________________________。
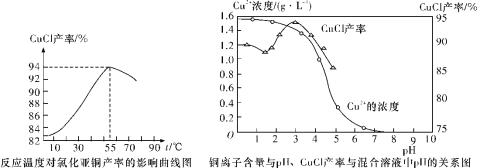
(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq) ![]() CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
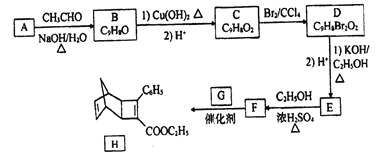
已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1) E的结构简式为_______。
(2) E生成F的反应类型为_______。
(3) 1mol化合物H最多可与_______molH2发生加成反应。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为______。
(5)芳香化合物X是F同分异构体,X能与饱和碳酸氢钠反应放出CO2,其核磁共振氢谱显示有4种不同化学环境氢,峰面积比之为6:2:1:1,写出1种符合要求的X的结构简式_____。
(6)写出用环戊烷和2-丁炔为原料制备化合物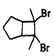 的合成路线(其他试剂任选)_____。
的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知正四面体形分子E和直线形分子G反应生成四面体形分子L和直线形分子M(组成E的元素的原子序数都小于10,组成G的元素为第三周期元素)的反应过程如图所示,则下列判断正确的是( )

A.常温常压下,L是一种液态有机物
B.E是一种含有非极性键的分子
C.G能使干燥的有色布条褪色
D.该反应是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与![]() 互为同分异构体的是( )
互为同分异构体的是( )
A.OHCCH2CH2CHOB.CH3CH2OCH2CH2OH
C.CH3CH=CHCOOHD.HOCH2CH=CHCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(1) △H1=-1214.6kJ/mol;
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol;
则反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=___。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是___。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
起始量/mol | 平衡量/mol | |||||
实验组 | 温度/℃ | H2O | CO | CO2 | CO | 达到平衡所需时间/min |
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中,以v(H2)表示的平均反应速率为___;
②该反应的正反应为___ (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是___(用含a、b的数学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com