
【题目】一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O=MnOOH+OH-,下列说法正确的是

A.铝电极上的电极反应式:Al-3e-=Al3+
B.电池工作时,NH4+移向石墨电极
C.每消耗2.7g铝就会有0.3mol电子通过溶液转移到正极上
D.放电过程中正极附近溶液的pH减小
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,装置如图,下列说法中正确的是
Cu2O+H2↑,装置如图,下列说法中正确的是

A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A元素的最高正价与最低负价和为零,C是同周期中原子半径最大的元素,D是同周期中离子半径最小的元素。C的单质在加热条件下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物F。试根据以上叙述回答:
(1)D元素在周期表中位置为_____________________;
(2)画出E的离子结构示意图_____________;写出ABE分子的结构式____________;
(3)工业上常用在微波条件下用A单质与EB2反应来解决其产生的环境问题,写出该化学方程式:___________________________________________;
(4)用电子式表示C2E的形成过程__________________________________________;
(5)1 mol F与A元素的最高价氧化物反应时转移的电子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含![]() 等)制备
等)制备![]() 的流程如图所示。
的流程如图所示。

已知:Ⅰ在酸性条件下,![]() 能将
能将![]() 还原为
还原为![]()
Ⅱ. ![]() 的氧化性强于
的氧化性强于![]()
Ⅲ. 相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| 4.9 | 6.8 |
| 1.5 | 2.8 |
回答下列问题:
(1)向含铬废水中加入![]() 调节
调节![]() ,目的是__________。
,目的是__________。
(2)写出“氧化”步骤中反应的例子方程式_________。
(3)“加热”操作的目的是________。
(4)“酸化”过程中发生反应![]()
![]() 已知,“酸化”后溶液中
已知,“酸化”后溶液中![]() 则溶液中
则溶液中![]() =________。
=________。
(5)“结晶”后得到![]() 产品0.3000g,将其溶解后用稀
产品0.3000g,将其溶解后用稀![]() 酸化,再由浓度为
酸化,再由浓度为![]() 标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
(6)在![]() 存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
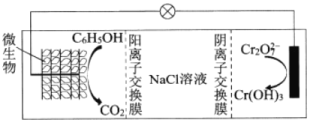
①负极的电极反应式为_________;
②处理过程中,需严格控制正极附近的pH,理由是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是
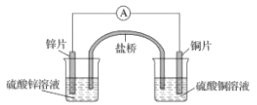
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
D.锌电极发生氧化反应;铜电极发生还原反应,其电极反应是2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质,请在横线上按要求归类。
①H2 ②He ③KOH ④CO2 ⑤H2O2 ⑥CaCl2 ⑦NH4Cl
(1)只由非极性键构成的物质是______________;
(2)由离子键和极性键构成的物质是______________;
(3)属于离子化合物的物质是______________;
(4)⑤H2O2的电子式为:______________;
(5)用电子式表示⑥CaCl2的形成过程:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24 L己烷中共价键数目为1.9NA
B.2 L 0.5 mol/L亚硫酸溶液中含有的H+数为2NA
C.高温下,16.8 g Fe与足量的水蒸气完全反应转移的电子数为0.8NA
D.在密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
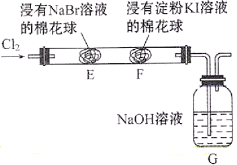
A.E处棉花球变成橙黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
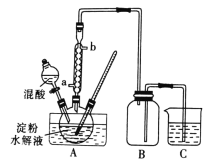
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%H2SO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________;步骤②中,水浴加热的优点为___________________。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___C6H12O6 + ___HNO3![]() ____+__________H2C2O4 + 9NO2↑ + 3NO↑+ ______。
____+__________H2C2O4 + 9NO2↑ + 3NO↑+ ______。
(3)称取m g草酸晶体粗产品,配成100 mL溶液。取20.00 mL于锥形瓶中,用a moL·L-1KMnO4标准液标定,只发生5H2C2O4 + 2MnO4- + 6H+ = 2Mn2+ + 10CO2↑ + 8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择上述装置验证产物CO2,装置B的主要作用是__________。
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
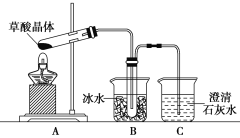
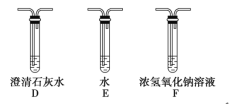
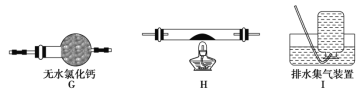
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________。其中装置H反应管中盛有的物质是________________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com