
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24 L己烷中共价键数目为1.9NA
B.2 L 0.5 mol/L亚硫酸溶液中含有的H+数为2NA
C.高温下,16.8 g Fe与足量的水蒸气完全反应转移的电子数为0.8NA
D.在密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为检验淀粉水解的情况,进行如下图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6 min,试管乙不加热。待试管甲中的溶液冷却后再进行后续实验。

实验1:取少量甲中溶液,加入新制氢氧化铜,加热,没有砖红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验3:取少量丙中溶液加入NaOH溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式: 。
(2)设计甲和乙是为了探究 对淀粉水解的影响,设计甲和丙是为了探究 对淀粉水解的影响。
(3)实验1失败的原因是 。
(4)实验3中溶液的颜色无明显变化的原因是 。
(5)下列结论合理的是 (填字母)。
a.淀粉水解需要在催化剂和一定温度下进行
b.欲检验淀粉是否完全水解,最好在冷却后的水解液中直接加碘
c.欲检验淀粉的水解产物具有还原性,应先在水解液中加入氢氧化钠中和稀硫酸至溶液呈碱性,再加入新制氢氧化铜并加热
d.若用唾液代替稀硫酸,则实验1可能出现预期的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )
A. 蚕丝属于天然高分子材料
B. 蚕丝的主要成分是蛋白质
C. 古代的蜡是高级脂肪酸酯,属于高分子聚合物
D. “蜡炬成灰”过程中发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O=MnOOH+OH-,下列说法正确的是

A.铝电极上的电极反应式:Al-3e-=Al3+
B.电池工作时,NH4+移向石墨电极
C.每消耗2.7g铝就会有0.3mol电子通过溶液转移到正极上
D.放电过程中正极附近溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲烷燃料电池为例来分析在不同的环境中电极反应的书写方法:
(1)碱性条件下燃料电池的负极反应:______________。
(2)碱性条件下燃料电池的正极反应:______________。
(3)固体电解质(高温下能传导O2-)环境中电池的负极反应:______________。
(4)固体电解质(高温下能传导O2-)环境中电池的正极反应:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某有机物分子式为C4H10O,并能与钠反应放出氢气(不含立体异构),其同分异构体数目为5
B.乙烯和苯均能使溴水褪色,且原理相同
C.用水可鉴别乙醇和乙酸乙酯
D.与Na反应的剧烈程度:CH3COOH>CH3CH2OH>H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
I.乳酸(![]() )、酒精、醋酸、淀粉等都是生活中常见的物质。
)、酒精、醋酸、淀粉等都是生活中常见的物质。
(1)在生活中,常选择上述物质中_______________(填结构简式)清洗水壶里的水垢。
(2)生活中常选择_______________酒精![]() 选择“75%”“95%”或“无水”
选择“75%”“95%”或“无水”![]() 皮肤消毒。
皮肤消毒。
(3)上述物质中,属于天然高分子化合物的是_________________![]() 填名称
填名称![]() 。
。
(4)乳酸中发生如下变化:![]() ,则所用的试剂a为________(写化学式)。
,则所用的试剂a为________(写化学式)。
II.X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的最外层电子数是次外层的2倍 |
Y | M层上的电子数是K层的3倍 |
Z | Z的一种核素的质量数为53,中子数为34 |
W | W2+与氖原子具有相同核外电子排布 |
(5)X在元素周期表中的位置为___________;Y元素的名称为________________。
(6)元素W的离子结构示意图是_______________;Z、Y形成的化合物为____________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:
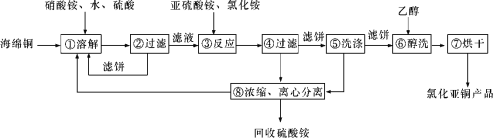
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:____________________________________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是__________(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是_____________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:_____。
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是____________________________________;温度过高、pH过大也会影响CuCl产率的原因是_______________________________。
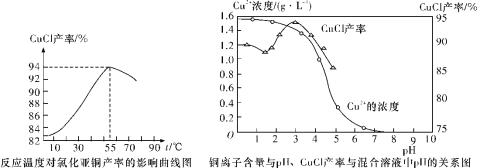
(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq) ![]() CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与![]() 互为同分异构体的是( )
互为同分异构体的是( )
A.OHCCH2CH2CHOB.CH3CH2OCH2CH2OH
C.CH3CH=CHCOOHD.HOCH2CH=CHCH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com