
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示。
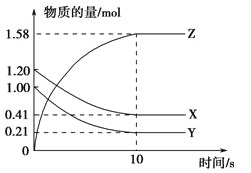
(1)从反应开始到10 s,用Z表示的反应速率为____。X的物质的量浓度减少了___,Y的转化率为_____。
(2)该反应的化学方程式为____。
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是_____。

A.t1时刻,增大了X的浓度 B.t1时刻,缩小了容器体积
C.t1时刻,升高了体系温度 D.t1时刻,使用了催化剂
【答案】0.079mol/(L·s) 0.395mol/L 79% X(g)+Y(g)![]() 2Z(g) BD
2Z(g) BD
【解析】
由图可知,X、Y为反应物,Z为生成物,X、Y、Z的化学计量数之比为(1.20—0.41)mol:(1.00—0.21)mol:(1.58—0)mol=1:1:2,则反应的化学方程式为X(g)+Y(g)![]() 2Z(g),该反应是一个气体体积不变反应。
2Z(g),该反应是一个气体体积不变反应。
(1)由图像可知,从反应开始到10 s,反应生成Z的物质的量为1.58mol,2L容器中Z浓度增加的量为![]() =0.79mol/L,则用Z表示的反应速率为
=0.79mol/L,则用Z表示的反应速率为![]() =
=![]() =0.079mol/(L·s);X的物质的量减少了(1.20—0.41)mol=0.79mol,2L容器中X的物质的量减少了
=0.079mol/(L·s);X的物质的量减少了(1.20—0.41)mol=0.79mol,2L容器中X的物质的量减少了![]() =0.395mol/L;Y的起始物质的量为1.00mol,反应消耗Y的物质的量为(1.00—0.21)mol=0.79mol,则Y的转化率为
=0.395mol/L;Y的起始物质的量为1.00mol,反应消耗Y的物质的量为(1.00—0.21)mol=0.79mol,则Y的转化率为![]() ×100%=79%,故答案为:0.079mol/(L·s);0.395mol/L;79%;
×100%=79%,故答案为:0.079mol/(L·s);0.395mol/L;79%;
(2)反应中各物质的物质的量变化量之比等于各物质的化学计量数之比,由图可知,X、Y为反应物,Z为生成物,X、Y、Z的化学计量数之比为(1.20—0.41)mol:(1.00—0.21)mol:(1.58—0)mol=1:1:2,则反应的化学方程式为X(g)+Y(g)![]() 2Z(g),故答案为:X(g)+Y(g)
2Z(g),故答案为:X(g)+Y(g)![]() 2Z(g);
2Z(g);
(3)由反应方程式可知,该反应是一个气体体积不变反应,由图可知,改变反应条件,反应速率加快,但是正逆反应速率相等,化学平衡不移动,则改变的条件可能为缩小容器的容积增大压强或加入合适的催化剂,BD正确,故答案为:BD。


科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生反应后各物质的物质的量随时间变化的曲线如图所示。

回答下列问题:
(1)该反应的反应物和生成物分别是_______________,反应方程式为_______。
(2)0~10 s的平均反应速率v(H2)= ________v(HI)=____________________。
(3)根据上述反应速率数值,分析用不同物质表示同一化学反应在同一时间内,化学反应速率值是否必须相同?_________________________________________。
(4)能否用I2(s)表达该反应的反应速率,为什么?__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④B. ②③C. ②④D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下面的能量变化示意图,下列热化学方程式正确的是

A. 2A(g)+ B(g)=2C(g)△H=a(a>0)B. 2A(g)+ B(g)=2C(g)△H=a(a<0)
C. 2A + B=2 C△H=a(a<0)D. 2C=2A +B△H=a(a>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
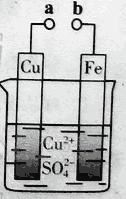
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是____________________。再由a向c中加2 mL蒸馏水,c中的实验现象是 ___________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____________。理由是_____________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国广泛采用将干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,用其取代氯气对自来水消毒,从而降低自来水中的氯残留对人体健康的影响。
(1)在ClO2分子中氯元素的化合价是______________。
(2)表示这一反应的化学方程式是________________________________,和欧洲的方法相比,我国这一方法的主要优点是生产出的ClO2中不含Cl2杂质。
(3)在酸性溶液中,用草酸钠(Na2C2O4)还原NaClO3也可制得ClO2,表示这一反应的化学方程式是________________________________,此法的优点是ClO2可被CO2稀释(Na2C2O4的氧化产物是CO2)。
(4)根据上述原理,北京绿先锋环保科技有限责任公司生产的“绿先锋消毒剂”是由两组固体试剂组成的。其使用方法见下图:

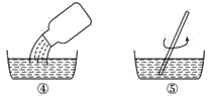
小瓶内盛的白色固体是________________,瓶胆内盛的白色固体是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g);ΔH1=-393.15kJ·mol-1 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g) +H2(g);ΔH2 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g);ΔH3=-566kJ·mol-1 ③
2H2(g)+O2(g)=2H2O(g);ΔH4=-484kJ·mol-1 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_______(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH2=______。
(3)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减 少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1,NO(g)+![]() O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=________。
O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=________。
(4)在标准状况下的11.2L甲烷完全燃烧生成CO2和液态水放出444.8kJ热量(298K),能表示其燃烧热的热化学方程式是________;已知断裂1mol下列化学键需要吸收的能量分别为:C=O:745kJ;O=O键:496kJ;C-H键:414kJ,则断裂1molH-O键需要吸收的能量为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com