
【题目】把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g);ΔH1=-393.15kJ·mol-1 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g) +H2(g);ΔH2 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g);ΔH3=-566kJ·mol-1 ③
2H2(g)+O2(g)=2H2O(g);ΔH4=-484kJ·mol-1 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_______(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH2=______。
(3)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减 少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1,NO(g)+![]() O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=________。
O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=________。
(4)在标准状况下的11.2L甲烷完全燃烧生成CO2和液态水放出444.8kJ热量(298K),能表示其燃烧热的热化学方程式是________;已知断裂1mol下列化学键需要吸收的能量分别为:C=O:745kJ;O=O键:496kJ;C-H键:414kJ,则断裂1molH-O键需要吸收的能量为_______。
【答案】等于 +131.85kJ/mol -317.3kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-889.6 kJ/mol 511.9kJ
【解析】
根据盖斯定律的定义与应用进行求解。
(1)根据盖斯定律,化学反应中的能量变化只与物质的始态与终态有关,则途径Ⅰ放出的热量理论上等于途径Ⅱ;
(2)根据盖斯定律,①-(③+④)/2,即可得到C(s)+H2O(g)=CO(g) +H2(g),则ΔH2=[-393.15+(566+484)/2]kJ/mol=+131.85kJ/mol;
(3)已知①NO(g)+O3(g)=NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1,②NO(g)+![]() O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,根据盖斯定律①+2×②,即可得到3NO(g)+O3(g)=3NO2(g),则ΔH=-200.9 kJ/mol-58.2×2 kJ/mol=-317.3kJ/mol;
O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,根据盖斯定律①+2×②,即可得到3NO(g)+O3(g)=3NO2(g),则ΔH=-200.9 kJ/mol-58.2×2 kJ/mol=-317.3kJ/mol;
(4)甲烷的燃烧热为1mol甲烷完全燃烧生成二氧化碳气体和液态水,则燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-889.6 kJ/mol;根据旧键的断裂吸热,新键的形成放热,则4×414+2×496-2×745-4×X=-889.6,解得X=511.9,则断裂1molH-O键需要吸收511.9kJ的热量。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示。
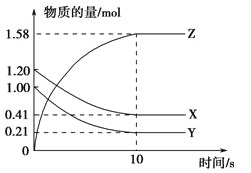
(1)从反应开始到10 s,用Z表示的反应速率为____。X的物质的量浓度减少了___,Y的转化率为_____。
(2)该反应的化学方程式为____。
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是_____。

A.t1时刻,增大了X的浓度 B.t1时刻,缩小了容器体积
C.t1时刻,升高了体系温度 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室常用来制备氯气的化学方程式为_____________________________________;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(ΔH)分别为-890.3kJ·mol-1、-285.8kJ.mol-1和-283.0kJ.mol-1,则生成1m3(标准状况)CO所需热量为________________;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为
____________________________________________;
(4)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):

①计算反应在第8min时的平衡常数K=__________________;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)_____T(8)
(填“<”、“>”或“=”),
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=_______mol·L-1;
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率(平均反应速率分别以v(2-3)、v(5-6)、v(12-13))的大小_______________________________________;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6)_____v(15-16)(填“<”、“>”或“=”),原因是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的装置如图所示:

(1)实验原理:______________。
(2)实验装置:气体制备型化学实验装置的设计,要将化学反应原理、气体净化、收集和尾气处理等结合起来。
①填写装置中试剂名称,C______________,D____________,F__________。
②其中C的作用是除去氯气中的____________;D的作用是除去氯气中的____________。
③该装置中收集氯气使用的是________,还可用排__________的方法,原因是_____________。
④其中F的作用是_____________。
⑤检验氯气是否收集满可用__________放在集气瓶口,若试纸______,则证明已集满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升____________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_______。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6 kJmol-1
2SO3(g) ΔH1=﹣196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJmol-1
2NO2(g) ΔH2=﹣113.0kJmol-1
则反应NO2(g)+ SO2(g)![]() SO3(g)+NO(g)的ΔH=________kJmol-1。
SO3(g)+NO(g)的ΔH=________kJmol-1。
一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________(填字母)
a.混合气体密度保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将_______(填“增大”“减小”或“不变”)。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣a kJmol-1。在一定温度下,将1molCO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则v(CH3OH)为_______,正反应放出的热量为______。
CH3OH(g) ΔH=﹣a kJmol-1。在一定温度下,将1molCO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则v(CH3OH)为_______,正反应放出的热量为______。
(4)已知N2O4(g)![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是_______。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是_______。
A.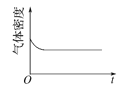 B.
B.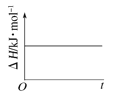 C.
C.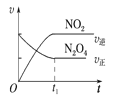 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
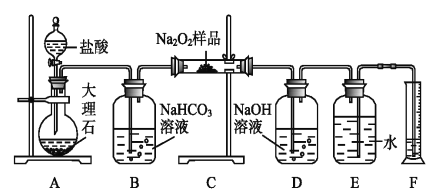
①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________?
(2)参加反应的铁的质量是多少________?
(3)标况下生成氢气的体积是多少________?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较元素非金属性的相对强弱:![]() ________
________![]() (填“>”、“<”或“=”);用一个化学方程式说明
(填“>”、“<”或“=”);用一个化学方程式说明![]() 与
与![]() 氧化性的相对强弱________。
氧化性的相对强弱________。
(2)离子化合物![]() 可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出
可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)半导体材料单晶硅的熔点高、硬度大,主要原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com