
【题目】一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O2NH3+ ![]() O2 , 进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
O2 , 进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
T/℃ | 30 | 40 | 50 |
生成NH3量/(10﹣6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为molh﹣1 .
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是 . 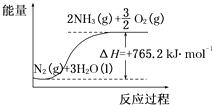
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议: .
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 在某压强恒定的密闭容器中加入2mol N2和4mol H2 , 达到平衡时,N2的转化率为50%,体积变为10L.求: ①该条件下的平衡常数为;
②若向该容器中加入a mol N2、b mol H2、c mol NH3 , 且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量(填“>”“<”或“=”)92.4kJ.
【答案】
(1)1.5×10﹣6
(2)N2(g)+3H2O(l)=2NH3(g)+ ![]() O2(g)△H=+765.2kJ?mol﹣1
O2(g)△H=+765.2kJ?mol﹣1
(3)升高温度
(4)400;<
【解析】解:(1)50℃时从开始到3h内生成氨气为6×10﹣6mol,则生成氧气为4.5×10﹣6mol,以O2物质的量变化表示的平均反应速率为 ![]() molh﹣1=1.5×10﹣6molh﹣1 , 所以答案是:1.5×10﹣6;(2)由图可知反应物、生成物及能量变化,反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+
molh﹣1=1.5×10﹣6molh﹣1 , 所以答案是:1.5×10﹣6;(2)由图可知反应物、生成物及能量变化,反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+ ![]() O2(g)△H=+765.2kJmol﹣1 , 所以答案是:N2(g)+3H2O(l)=2NH3(g)+
O2(g)△H=+765.2kJmol﹣1 , 所以答案是:N2(g)+3H2O(l)=2NH3(g)+ ![]() O2(g)△H=+765.2kJmol﹣1;(3)由数据可知,温度越高,生成氨气的量越大,则可提高其反应速率且增大NH3生成量的建议为升高温度,所以答案是:升高温度;(4)①某压强恒定的密闭容器中加入2mol N2和4mol H2 , 达到平衡时,N2的转化率为50%,体积变为10L,则
O2(g)△H=+765.2kJmol﹣1;(3)由数据可知,温度越高,生成氨气的量越大,则可提高其反应速率且增大NH3生成量的建议为升高温度,所以答案是:升高温度;(4)①某压强恒定的密闭容器中加入2mol N2和4mol H2 , 达到平衡时,N2的转化率为50%,体积变为10L,则
N2(g)+ | 3H2(g) | 2NH3(g) | ||
开始 | 2 | 4 | 0 | |
转化 | 1 | 3 | 2 | |
平衡 | 1 | 1 | 2 |
K=  =400,
=400,
所以答案是:400;②当加入2mol N2和4mol H2时,生成2mol NH3 , 放出92.4kJ的热量,而当加入a mol N2、b mol H2和c mol NH3时,平衡时NH3仍为2mol,则生成的NH3为(2﹣c) mol,则放出的热量小于92.4kJ,所以答案是:<.
【考点精析】解答此题的关键在于理解反应速率的定量表示方法的相关知识,掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】如图所示,圆底烧瓶中充满干燥的氯气,将胶头滴管中的浓氨水挤入圆底烧瓶中,发生反应:2NH3+3Cl2=N2+6HCl,同时生成白烟并发红光。回答下列问题。
(1)实验室制氨气的化学反应方程式是:____________________________。
(2)在2NH3+3Cl2=N2+6HCl反应中,氨气表现了___________的化学性质, 请列举出NH3的另一个化学性质:__________________________。
(3)实验中生成的白烟是_____________________。
(4)反应完成后,将导管插入烧杯的水面下,并打开止水夹,观察到有水吸入烧瓶中形成喷泉,当喷泉停止后,烧瓶___________(填“能”或“不能”)被水充满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物H是一种可用于治疗肿瘤的药物,其合成路线如图所示:

已知:
(1) E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色
(2) H的结构简式为
(3) RCOOH![]() (R为烃基)
(R为烃基)
(4) 
请回答下列问题:
(1)A的苯环上有____种不同化学环境的氢原子。
(2)④的反应条件是________该反应的类型是_______;l molH最多可以和____mol NaOH 反应。
(3)G的结构简式为__________。
(4)D在一定条件下可以聚合形成高分子,写出该反应的化学方程式__________。
(5)E有多种同分异构体,同时满足下列条件的E且含有苯环的同分异构体有_____种。
①能发生银镜反应 ②能发生水解反应 ③分子中含的环只有苯环
(6)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2 为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1L 1mol/L 的NaOH溶液吸收0.8mol CO2 ,则所得溶液中碳酸根和碳酸氢根的物质的量的浓度之比约为
A. 1:3 B. 2:1 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。

①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯分子中不存在C—C键和C=C键交替结构,下列事实不能说明的是
A.苯不能使酸性高锰酸钾溶液褪色
B.苯分子中碳碳键的键长都相等
C.苯在加热和催化剂存在条件下与氢气反应生成环己烷
D.苯能与液溴发生取代反应,但不能与溴水发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒,其中N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )

A. 该反应的还原剂是Cl-
B. 反应后溶液的酸性明显增强
C. 消耗1mol还原剂,转移6mol电子
D. 氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com