
【题目】用1L 1mol/L 的NaOH溶液吸收0.8mol CO2 ,则所得溶液中碳酸根和碳酸氢根的物质的量的浓度之比约为
A. 1:3 B. 2:1 C. 2:3 D. 3:2
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐( 主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)请写出镓(与铝同主族的第四周期元素)的原子结构示意图_________。
(2)为尽量少引入杂质,试剂①应选用______(填标号)。理由是______________。
A.HCl溶液 B.H2SO4 溶液 C.氨水 D.NaOH溶液
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是________(用离子方程式表示)。
(4)科学研究证明NaAlO2 在水溶液中实际上是Na[Al(OH)4](四羟基合铝酸钠),易拉罐溶解过程中主要反应的化学方程式为___________________。
(5)常温下,等pH的NaAlO2 和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=__________。
(6)已知室温下,Kw=10×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示,

判断下列叙述中正确的是
A. 每生成2分子AB吸收bkJ热量
B. 该反应热△H=+(a-b)kJ·mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1molA—A和1molB—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( )
A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱 D. HTs易溶于水,稳定性强,还原性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O2NH3+ ![]() O2 , 进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
O2 , 进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
T/℃ | 30 | 40 | 50 |
生成NH3量/(10﹣6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为molh﹣1 .
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是 . 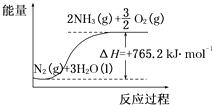
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议: .
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 在某压强恒定的密闭容器中加入2mol N2和4mol H2 , 达到平衡时,N2的转化率为50%,体积变为10L.求: ①该条件下的平衡常数为;
②若向该容器中加入a mol N2、b mol H2、c mol NH3 , 且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量(填“>”“<”或“=”)92.4kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
①该电池的负极材料是______________。电池工作时,电子流向______________(填“正极”或“负极”)。
②若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是______________。欲除去Cu2+,最好选用下列试剂中的______________(填字母序号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(2)给你提供纯锌片、纯铜片和500mL0.2mol·L-1的H2SO4溶液、导线、1000mL量筒。试用右图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
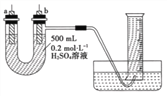
①装置气密性良好,且1000mL量筒中已充满了水,则开始实验时,首先要______________。
②a电极材料为______________,其电极反应式为______________;b电极材料为______________,其电极反应式为______________。
③当量筒中收集672mL气体时(已折算成标准状况下),通过导线的电子的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C可能是下列各组中的
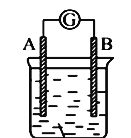
A. A是Ag,B是Fe,C为稀AgNO3溶液
B. A是Cu,B是Zn,C为稀H2SO4
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Zn,B是Cu,C为稀H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com