
【题目】镁——H2O2酸性电池采用海水作电解质(加入一定量酸),下列说法正确的是( )
A.电池总反应为Mg+H2O2+2H+=Mg2++ 2H2O
B.负极反应为H2O2+2e-+ 2H+= 2H2O
C.电池工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
Ⅰ催化还原法
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ/mol
则CH4将NO2还原为N2的热化学方程式为____________________________。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是_______________(写出1条即可)。
2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是_______________(写出1条即可)。
(3)在汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。主要反应如下:2NO(g)+ 2CO(g)![]() N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6molL-1。
N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6molL-1。
①前10分钟内用氮气表示的反应速率为___________,计算该温度下反应的平衡常数K为______Lmol-1。(只列算式,不要求计算结果)
②若保持温度不变,在15分钟时向容器内再次充入NO 1.6 mol、CO2 0.4 mol,则此时反应的ν正___ν逆(填“<”、“=”或“> ”)
II 氧化法。
(4)首先利用ClO2 氧化氮氧化物,再利用还原剂还原为无毒的氮气。其转化流程如下:
NO![]() NO2
NO2![]() N2。
N2。
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是_____________________________;若生成11.2 L N2(标准状况),则消耗ClO2____________g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 氨水中加酸,NH4+ 的浓度增大
B. 装有NO2和N2O4平衡的混合气体的玻璃球在冷水中气体颜色变浅
C. 实验室中常用排饱和食盐水的方法收集Cl2
D. H2、I2、HI的体系平衡后,加压混合气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子 Amol·L-1与Bmol·L-1,则A和B关系为( )
A. A>B B. A=10-4 B C. B=10-4 A D. A=B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A. 氧化铁是一种碱性氧化物,常用作红色油漆和涂料
B. 在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多
C. Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
D. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 , 生成SO2的体积为(标准状况下)mL.
(2)若题干中浓硫酸的物质的量浓度为a molL﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)0.025a mol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
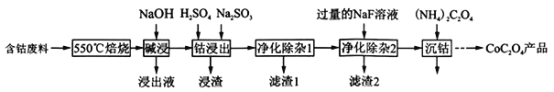
已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是____________________ (用离子方程式表示);再升温至80~85℃,加入___________溶液,调pH至4.5以达到净化除杂的目的。
(5)“净化除杂2”过程中,若溶液c(Ca2+)=0.01mol/L,使Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5mol/L,此时是否有CaF2沉淀生成________________?(列式计算)[已知Ksp(MgF2) =7.0×10-11、Ksp(CaF2) =1.0×10-10]。
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com