
【题目】下图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
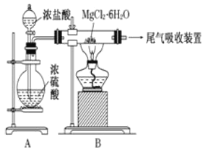
A.装置A中圆底烧瓶中可以换成固体MnO2
B.如果直接加热MgCl26H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO
C.尾气吸收可以用浓硫酸作为吸收剂进行吸收
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火
【答案】B
【解析】
A.浓硫酸有吸水性,浓盐酸有挥发性,将浓盐酸加入到浓硫酸中会产生HCl气体,在酸性环境中可以抑制Mg2+水解而制取无水氯化镁,若将浓硫酸换为MnO2,则不能产生HCl,因此不能得到无水氯化镁,错误;
B.如果直接加热MgCl26H2O,则MgCl2水解,不能得到无水氯化镁,将得到Mg(OH)Cl或MgO,正确;
C.尾气中含有HCl,不能被浓硫酸吸收,应该用水作吸水剂,由于HCl极容易溶于水,因此在用水作吸水剂时要注意防止倒吸现象的发生,错误;
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,由于Mg可以与CO2发生反应,因此不能用二氧化碳灭火器进行灭火,错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期目的的是
选项 | 实验操作 | 预期目的 |
A | 充满NO2的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
B | 向盛有 1 mL 硝酸银溶液的试管中滴加 NaCl 溶液至不再有沉淀产生,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种更难溶的沉淀 |
C | 苯酚和水的浊液中,加稍过量浓碳酸钠溶液 | 比较苯酚与碳酸的酸性 |
D | 向2支试管中加入同体积同浓度H2C2O4溶液, 再分别加入同体积不同浓度的酸性KMnO4溶液 | 依据褪色时间来研究浓度对反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是( )
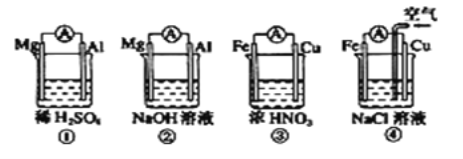
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为2H2O+2e-=2OH-+H2↑
C.③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D.④中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确且能达到相应目的的是
选项 | 实验目的 | 实验操作 |
A | 称取2.0gNaOH固体 | 先在托盘上各放1张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
B | 配制稀硫酸 | 先将浓硫酸加入烧杯,后倒入蒸馏水 |
C | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
D | 检验溶液中是否有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关甲、乙、丙、丁四个图示的叙述正确的是( )

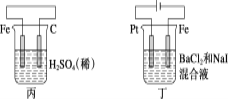
A.甲中负极反应式为2H++2e-=H2↑
B.乙中阳极反应式为Ag++e-=Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.制取Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.锅炉除水垢时先用纯碱浸泡:CaSO4+CO32-=CaCO3+SO42-
C.泡沫灭火器灭火原理:2Al3++3CO32-+3H2O =2Al(OH)3↓+3CO2↑
D.碳酸钠溶液显碱性:CO32-+2H2OH2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入____________溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 molL-1,应保持溶液中c(Ba2+)≥__________mol·L-1。
(3)步骤③中判断滴定终点的方法是_____________________。
(4)通过计算确定铁钾矾的组成(写出计算过程)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
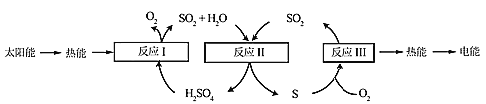
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示:
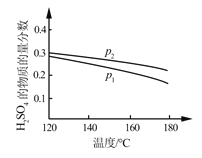
p2_______p 1(填“>”或“<”)。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+_________=_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到 2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示。则b电极上的电极反应式为__________________。
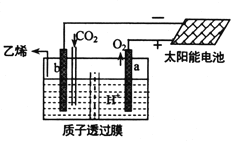
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图甲是高铁电池的实验装置:已知放电后,两极得到铁的相同价态的化合物。

(1)该电池放电时正极发生的电极反应是___________。
(2)若该电池属于二次电池,则充电时阴极反应的电极反应式为___________ 。
(3)已知盐桥中含有饱和KCl溶液,放电时,盐桥的作用是___________。此盐桥中阴离子的运行方向是___________;若用某种高分子材料制成隔膜代替盐桥,该隔膜允许通过的离子是___________。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为___________mol·L1,此时溶液中c(CrO42-)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com